广东省药品批发企业GSP认证现场检查项目表
2025-03-26
—1— 广东省药品批发企业 GSP认证 现场检查项目表(试行) 项目 编号 检 查 内 容 *1001 企业应按依法批准的经营方式、经营范围、注册地址和仓库地址,从事药品经 营活动。 1002 企业应建立以主要负责人为首, 包括质量负责人、质量管理机构负责人和采购、 销售、储运等业务部门负责人在内的质量领导组织。 1003 企业质量领导组织的主要职责是:建立企业的质量体系,实施企业质量方针, 并保证企业质量管理工作人员行使职权。 *1004 企业应在高级管理人员中设立专人担任质量负责人,全面负责与药品质量管理 相关的工作,在企业内部对药品质量具有裁决权,对企业药品质量管理承担直 接责任。 1005 企业质量负责人应有履行其职责所需的必要权力和资源,保证质量管理体系的 有效运行。 *1006 企业质量负责人应负责组织编制、 审定企业药品质量管理制度 ;质量管理机构应 负责起草并指

1/16 广东省药品批发企业gsp认证现场检查项目表(试行)考试卷答案 得分: 一、单选题(每题0.5分,共26题,13分) 1.广东省药品批发企业gsp认证现场检查项目表(试行)发布执行时间() a2012年1月11日 b2012年3月1日 c2012年4月1日 d2012年2月11日 2.药品批发企业gsp认证检查项目共分140项,其中关键项55项,一般项目85项,分()章: a7章 b6章 c5章 d4章 3.现场检查评定时,不合格项可评定为严重缺陷、一般缺陷。缺陷项目是指() a不齐全的项目 b不完整的项目 c以上二者均是 d以上二均不是 4.直调药品时,如委托收货单位验收,应与收货单位签订() a药品委托验收协议书 b药品直调委托协议书 c药品委托储存协议书 d药品购销合同书 5.判定通过

关于印发《广东省药品批发企业gsp认证现场 检查项目表》(试行)的通知 时间:2012-1-17作者: 粤食药监通〔2012〕3号 各地级以上市食品药品监督管理局(药品监督管理局)、顺德区卫生和人口计划 生育局、省局审评认证中心: 为进一步规范我省药品经营秩序,我局制定了《广东省药品批发企业gsp 认证现场检查项目表》,现印发给你们。《检查项目表》自发文之日起执行,请 认真组织实施,工作中遇到的问题及时向我局药品流通监管处报告。 二○一二年一月十一日 附件:广东省药品批发企业gsp认证现场检查项目表(试行).doc gsp认证现场检查缺陷项目记录.doc 广东省药品批发企业gsp认证 现场检查项目表(试行) 项目 编号 检查内容 *1001 企业应按依法批准的经营方式、经营范围、注册地址和仓库地址,从事 药品经营活动。 1002 企业应建立以主要负责人为首
编辑推荐下载

1/12 广东省药品批发企业gsp认证现场检查项目表(试行)考试卷 姓名:得分: 一、单选题(每题0.5分,共26题,13分) 1.广东省药品批发企业gsp认证现场检查项目表(试行)发布执行时间() a2012年1月11日;b2012年3月1日;c2012年4月1日;d2012年2月11日 2.药品批发企业gsp认证检查项目共分140项,其中关键项55项,一般项目85项,分()章: a7章;b6章;c5章;d4章 3.现场检查评定时,不合格项可评定为严重缺陷、一般缺陷。缺陷项目是指() a不齐全的项目;b不完整的项目;c以上二者均是;d以上二均不是 4.直调药品时,如委托收货单位验收,应与收货单位签订() a药品委托验收协议书;b药品直调委托协议书;c药品委托储存协议书;d药品购销合同

附件3 广东省药品零售企业gsp认证现场检查项目表 (征求意见稿) 序号拟项目号拟修订内容 1*12401 企业应按依法批准的许可内容从事药品经营活动。并应坚持诚实守信,依法经营,禁 止虚假欺骗行为。 2*12402 企业应当具有与其经营范围和规模相适应的经营条件,包括组织机构、人员、设施设 备、质量管理文件,并按照规定设置计算机系统。 312501 企业负责人是药品质量的主要责任人。其职责是:负责企业日常管理,提供必要的药 品经营条件,保证质量管理部门或质量管理人员有效履行职责,确保企业按照本规范 要求经营药品。 4*12601 企业应当设置质量管理部门或者配备质量管理人员,履行以下职责: 1.督促相关部门和岗位人员执行药品管理的法律法规及本规范; 2.组织制订质量管理文件,并指导、监督文件的执行; 3.负责对供货单位及其销售人员资格证明的审核; 4.负责对所
热门文档 广东省药品批发企业GSP认证现场检查项目表
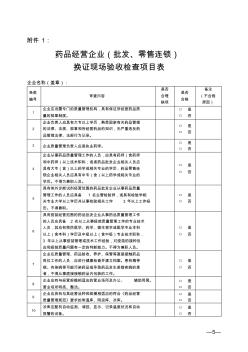
—5— 附件1: 药品经营企业(批发、零售连锁) 换证现场验收检查项目表 企业名称(盖章): 条款 编号 审查内容 是否 合理 缺项 是否 合格 备注 (不合格 原因) 1 企业应设置专门的质量管理机构,具有保证所经营药品质 量的规章制度。 □是 □否 2 企业负责人应具有大专以上学历,熟悉国家有关药品管理 的法律、法规、规章和所经营药品的知识,无严重违反药 品管理法律、法规行为记录。 □是 □否 3企业质量管理负责人应是执业药师。 □是 □否 4 企业从事药品质量管理工作的人员,应具有药师(含药师 和中药师)以上技术职称;或者药品批发企业相关人员应 具有大专(含)以上药学或相关专业的学历,药品零售连 锁企业相关人员应具有中专(含)以上药学或相关专业的 学历。不得为兼职人员。 □是 □否 5 具有体外诊断试剂经营范围的药品批发企业从事药品质量 管理工作的人员应具

药品零售连锁企业gsp认证检查项目(试行) 0401企业应按照依法批准的经营方式和经营范围,从事药品经营活动。 0501企业应建立以主要负责人为首,包括进货、销售、储运等业务部门负责人和企业质量 管理机构负责人在内的质量领导组织。 0502企业质量领导组织的主要职责是:建立企业的质量体系,实施企业质量方针,并保证 企业质量管理工作人员行使职权。 *0601企业应设置专门的质量管理机构,机构下设质量管理组、质量验收组。 0602企业质量管理机构应行全质量管理职能,在企业内部对药品质量具有裁决权。 0603企业质量管理机构应负责起草企业药品质量管理制度,并指导、督促制度的执行。 0604企业质量管理机构应负责首营企业和首营品种的质量审核。 0605企业质量管理机构应负责建立企业所经营药品并包括质量标准等内容的质量档案。 0606企业质量管理机构应负责药品质量的查询和药

药品批发零售连锁 新版gsp及检查项目解析 2013-07 内容 一、新版gsp基本情况概述 二、gsp及现场检查项目解析 三、专题介绍 一、基本情况概述—gsp 1、gsp 2、附录 3、现场检查项目 1、gsp:国务院部门规章。是药品经营管理和质量控制的基本准则。 共四章:总则、药品批发的质量管理、药品零售的质量管理、附则。条款共计187条,其中批发部分 118条,零售部分计59条附录 【修订原则】:“提高标准、完善管理,强化重点、突破难点” 【修订目标】:“全面推进一项管理手段、强化两个重点环节、突破三个难点问题” 一项管理手段——实施企业计算机管理信息系统; 两个重点环节——药品购销渠道和仓储温湿度控制; 三个难点——票据管理、冷链管理和药品运输 2、附录:国家总局的规范性文件,拟出台5个附录: (1)药品经营企业计算机系统 (2)药品储存运

食品销售单位现场情况检查简表 被检查单位名称:________________________地址:________________________________ 负责人:____________电话:_____________经营类别(备注):_____________________ 检查项目序号检查情况 检查发现问题的 描述 资格审查 1.1食品经营许可证 发现问题() 未发现问题() 1.2从业人员健康证 发现问题() 未发现问题() 1.3营业执照 发现问题() 未发现问题() 自律制度落 实情况 2.1食品进货台账 发现问题() 未发现问题() 2.2索证索票、进货检查、不合格食品退市 发现问题() 未发现问题() 贮存3.1食品按照标注存放 发现问题() 未发现问题() 食品管理 4.1是否在保质期内 发

1 云南省药品经营质量管理规范现场检查评定标准 2 说明 一、为规范《药品经营质量管理规范》检查工作,确保检查工作质量,根据《药品经营质量管理规范》(中华人 民共和国卫生部令第90号)、《药品经营质量管理规范现场检查指导原则》(国家食品药品监督管理总局食药监药 化监[2014]20号),制定《云南省药品经营质量管理规范现场检查评定标准》。 二、应当按照本评定标准中包含的检查项目和所对应的附录检查内容,对药品经营企业实施《药品经营质量管 理规范》情况进行全面检查。 三、按照本评定标准进行检查过程中,有关检查项目应当同时对照所对应的附录检查内容进行检查。如果附录 检查内容检查中存在任何不符合要求的情形,所对应的检查项目应当判定为不符合要求。 四、本评定标准批发企业检查项目共259项,其中严重缺陷项目(**)7项,主要缺陷项目(*)107项,一般 缺陷项目145项。
精华文档 广东省药品批发企业GSP认证现场检查项目表

1 二、工程准备阶段法定建设程序主要必备文件检查表 表2 序号文件名称检查结果备注 1 中标通知书(施工、监理)或议标审批 表(审核部门审核意见书) 2施工合同(含分包合同、补充合同等) 3监理合同(补充合同等) 4各责任主体及分包单位资质文件 5质量、安全监督登记表 6 建设用地规划许可证及附件、建设工程 规划许可证及附件 7 建筑工程施工许可证或相关建设主管部 门开工报告 8施工图设计文件审查意见书(设计文件 变更的审查意见) 9地下室工程人防审批表意见 10 涉及结构、建筑、节能等的重大变更批 准文件(包括审图机构的审查合格意见) 及超限审查 说明:1、上表列出的10项文件为建筑工程必备的基建程序主要文件,不能缺项。 2、检查通过的,在检查结果相应栏目中打勾(√),不通过的打叉(ⅹ)。 2 三、质量控制资料检查表之一(综合管理资料) 表3 类

进口药品境外检查ccd-sfda contentofsitemasterfile 现场主文件清单 1.generalinformationonthemanufacturer 企业总体情况 1.1contactinformationonthemanufacturer 企业联系信息 -nameandofficialaddressofthemanufacturer; 企业名称、注册地址; -namesandstreetaddressesofthesite,buildingsandproductionunits locatedonthesite; 企业生产工厂以及工厂内建筑及生产车间名称和地址; -contactinformationofthemanufacturerincluding24hrs

江西省体外诊断试剂经营企业(批发)gsp认证 检查评定标准 江西省食品药品监督管理局制 二○○七年十二月 编制说明 一、为规范本省体外诊断试剂经营企业(批发)的gsp认证检查,统一检查标准,根据国家食品药品监督管理局《关于印发体外诊断 试剂经营企业(批发)验收标准和开办申请程序的通知》、《药品经营许可证管理办法》、《药品经营质量管理规范》(2007.7.1)、《药品经营 质量管理规范实施细则》、《药品批发企业gsp认证检查评定标准》及《江西省体外诊断试剂经营企业(批发)验收标准细则》,特制定《江 西省体外诊断试剂经营企业(批发)gsp认证检查评定标准》(以下简称《标准》)。 二、本《标准》适用于江西省辖区内药品类体外诊断试剂经营企业(批发)的gsp认证检查。 三、本《标准》分八个部分:一、管理职责;二、人员与培训;三、设施与设备;四、进货;五、验收
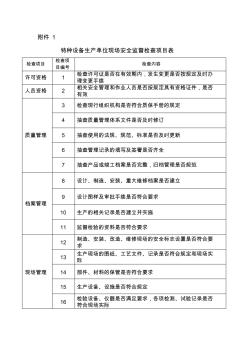
附件1 特种设备生产单位现场安全监督检查项目表 检查项目 检查项 目编号 检查内容 许可资格1检查许可证是否在有效期内,发生变更是否按规定及时办 理变更手续 人员资格2相关安全管理和作业人员是否按规定具有资格证件,是否 有效 质量管理 3检查现行组织机构是否符合质保手册的规定 4抽查质量管理体系文件是否及时修订 5抽查使用的法规、规范、标准是否及时更新 6抽查管理记录的填写及签署是否齐全 7抽查产品或竣工档案是否完整,归档管理是否规范 档案管理 8设计、制造、安装、重大维修档案是否建立 9设计图样及审批手续是否符合要求 10生产的相关记录是否建立并实施 11监督检验的资料是否符合要求 现场管理 12制造、安装、改造、维修现场的安全标志设置是否符合要 求 13生产现场的图纸、工艺文件、记录是否符合规定和现场实际 14部件、材料的保管是否符合要求 15生产

—1— 广东省食品药品监督管理局 日常检查记录表(试行) 1.食品生产环节; 2.食品经营环节-食品流通; 3.食品经营环节-餐饮服务、其他食品现场制售; 4.药品生产环节; 5.药品批发流通环节; 6.特殊药品经营流通环节; 7.药品零售连锁总部流通环节; 8.药品零售环节; 9.医疗器械生产环节; 10.医疗器械经营环节; 11.保健食品生产环节; 12.保健食品经营流通环节; 13.化妆品生产环节; 14.化妆品经营环节。 —2— 广东省食品药品监督管理局日常检查记录表 (食品生产环节) 检查部门: 被检查单位名称:许可证编号: 地址: 本表供日常检查使用,包括以飞行检查形式实施的日常检查,但国家总局已有特殊要求的检查不在此列。 不符合的项目须在备注栏注明情况。 检查内容检查项目 检查结果 备注 符合不符合 主体资格 1.食品生产许可证载明的企业名称与营业执照一致。
最新文档 广东省药品批发企业GSP认证现场检查项目表

生产企业现场检查情况记录表 生产 单位 产品 名称 规格 型号 项目 序号 项目内容评定结果 合格不合格 1所生产的医疗器械产品是否注册,注册证是否在有效期内。# 2生产的产品是否超出生产企业许可证及产品注册证的范围。# 3执行标准是否符合要求。 4产品使用说明书、合格证、包装、标识是否符合规定。 5是否配置与生产规模相适应的生产设备和工艺装备。 6是否确定了产品的关键过程和特殊过程(工序)并制定了相应的控制文件和 作业指导书。 7是否对产品要求的作业环境、产品清洁做出规定。 8是否有完善仓库管理规定文件,贮存条件是否符合标准要求,各类物资是否 分类存放,待验品、合格品、不合格品是否严格分开并有状态标识。 9是否对产品的可追溯性范围和程度进行了确定(材料、元件、过程和去向)。 10关键外购、外协件的分承包方是否按规定文件的要求进行评价。 11检验设备是否

企业安全生产检查项目表(全) 序号类别内容与要求检查方法责任部门 一、企业安全生产基础管理检查 1安全组织 1.企业安全管理机构及其负责人任命文件 2.企业主要负责人的安全资格证书 3.企业安全管理人员的安全资格证书 4.分管安全工作的负责人的任命文件及其培训证书 5.企业安全管理网络体系 1.查看安全管理机构设置文件及其管理人员 任命文件 2.查看各种证书的原件或复印件 3.查看企业安全管理体系网络设置情况(厂 级、车间级) 安全办 2 安全规章 制度 1.各级、各部门安全生产责任制 2.各类安全生产管理制度 3.各工种、岗位或设备安全操作规程 4.应急救援预案及其演练记录 5.上级部门有关安全生产方面的文件、通知及执行情况汇报、记录 6.企业上报的各种安全生产方面的计划、总结、报告等材料 1.查责任制、安全管理制度、操作规程、应急 预案文本 2.看上级有关安全方面文件或复印

1 附表1 安全生产检查项目表 单位名称 地址 主要 负责人 电话 安全员 电话 手机手机 安全生产检查项目检查情况 责任制 与机构 安全生产责任制的制定情况 设置相应的安全管理机构或者配备安全生产管理人员情况 安 全 生 产 规 章 制 度 安全生产教育和培训制度的制定情况 安全生产检查制度的制定情况 具有较大危险因素的生产经营场所、设备和设施的安全管理制 度的制定情况 危险作业管理制度的制定情况 劳动防护用品配备和管理制度的制定情况 相关的操作规程及其他保障安全生产的规章制度的制定情况 安 全 教 育 培 训 从业人员掌握安全生产知识及职责情况 安全生产教育培训内容的落实情况 从业人员接受安全教育培训时间落实情况 组织安全生产教育和培训相关的记录情况 特种作业人员持证上岗情况 安 全 生 产 检 查 2008年1至11月工伤事故情况,发生()

附件2 广东药检系统科研项目申报指南 为突出“为药品监督做方法”的科研方向,推动药检科学 与科学监管有机结合,针对目前药品监管技术支持存在的薄 弱环节和广东药检基层工作适应性问题,特提出2009年优 先实施“重点专项”项目申报指南。 项目课题申报单位须具有承担课题研究的能力和与本 项目研究相关的工作积累;课题负责人必须是主管药师以上 职称,具备相关研究基础和组织协调能力;研究团队结构合 理;鼓励多学科合作,建立科学合理的管理运行机制。 项目实施周期自2010年1月至2011年12月。 课题一:抗风湿镇痛类中成药擅自添加化学成分研究 1、研究内容 研究抗风湿镇痛类中成药中擅自添加解热镇痛消炎类 化学成分(又叫非甾体类抗炎药),如水杨酸类阿司匹林, 有机酸类吲哚美辛(又叫消炎痛)、双氯芬酸,其他类的氨 基比林和擅自添加肾上腺皮质激素类化学成分(又叫甾体类 抗炎药)

序号保养内容保养情况 1检查发动机油位 2检查冷却液液位 3检查刹车油油位 4检查液压油油位 5检查燃油油位,排除发动机上的燃油粗滤器中的水和杂质 6绕机目测检查各系统有无异常情况、泄漏。检查发动机风扇和驱动皮带 7检查各工作灯,指示灯等是否破损,电、气、油的线路、管路是否老化 或破损。 8 检查轮胎有否破损,充气是否足够(前轮:0.30-0.32mpa,后轮:0.28 -0.30mpa)。轮胎气压必须控制在规定的范围内。轮胎螺栓是否松 动,锁紧力为830n.m。 9检查后退报警器工作状况 10按照机器上张贴的整机润滑图的指示,向各传动轴加注润滑脂 11 向外拉动储气罐下方的手动放水阀拉环,给储气罐防水。当发现储气罐 出现较多积水时,表明安装于柴油箱前侧的空气干燥器的干燥剂已失 效,应急时更换干燥筒。 12检查变速箱油位 13检查刹车片磨损情况。 14检

《港口安全检查项目表》说明 1.代码0100—1400中的:0112、0113、0303、0415、0505、0802 —0810、1008、1009、1104、1105、1205、1206、1402—1404适用 于危险货物港口作业企业(以底纹加黑表示); 2.除上述第1点中指出的代码外,其余适用于所有港口企业。 3.本表一式两份,港口管理部门、港口经营人各一份。表内“标 记”栏由港口经营人根据现状实际填写,有的打“√”,并对照表格 列举项进行自查。 4.港口行政管理部门对照《港口安全检查项目表》进行全面检 查核实,按企业实际确定整改项目,出具“港口安全检查报告”,以 促企业逐步完善安全生产管理工作。 港口安全检查项目表 代码隐患内容标记 0100证照及有关文书 0101营业执照 0102港口经营许可证 0103码头的租赁合同及安全管
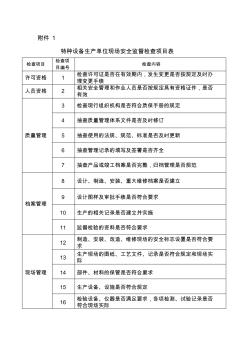
附件1 特种设备生产单位现场安全监督检查项目表 检查项目 检查项 目编号 检查内容 许可资格1检查许可证是否在有效期内,发生变更是否按规定及时办 理变更手续 人员资格2相关安全管理和作业人员是否按规定具有资格证件,是否 有效 质量管理 3检查现行组织机构是否符合质保手册的规定 4抽查质量管理体系文件是否及时修订 5抽查使用的法规、规范、标准是否及时更新 6抽查管理记录的填写及签署是否齐全 7抽查产品或竣工档案是否完整,归档管理是否规范 档案管理 8设计、制造、安装、重大维修档案是否建立 9设计图样及审批手续是否符合要求 10生产的相关记录是否建立并实施 11监督检验的资料是否符合要求 现场管理 12制造、安装、改造、维修现场的安全标志设置是否符合要 求 13生产现场的图纸、工艺文件、记录是否符合规定和现场实际 14部件、材料的保管是否符合要求 15生产

药品注册现场核查管理规定 第一章总则................................................................................................................2 第二章药品注册研制现场核查................................................................................4 第一节药物临床前研究现场核查.....................................................................4 第二节药物临床试验现场核查..............................................................

xxx水电厂 安全检查项目表 编制:xxx水电厂安技部 二0一二年元月 使用说明 为进一步搞好xxx水电站安全生产工作,根据国家小水电安全生 产有关政策、法规制定本表,供电站安全生产自查时使用,现将有关 事项作如下说明: 一、表中安全生产第一责任人为电站的法定代表人。 二、本表为电站自查时使用,并作为档案材料妥善保管,随时 供有关部门抽查。 三、填写“组织、制度部分”时,如有表中所列内容,则在“有” 一栏中打“√”,反之则在“无”一栏中打打“√”。表中可量化 指标在填写时使用数字说明,需要定性的指标如“是否正常”之 类,如正常填“正常”,反之填“不正常”,并在自查结果中加以 说明。 四、如果发现有检查项目未列在表中,请在备用表中加以补充。 五、用蓝黑、碳素墨水填写本表。 电站基本情况 检查时间:年月日 电站名称xxx 电站地
文辑创建者
我要分享 >
职位:建设项目环境影响评价
擅长专业:土建 安装 装饰 市政 园林
相关编辑
文辑推荐
知识推荐
百科推荐
