CUO
氧化铜(CuO)是一种铜的黑色氧化物,略显两性,稍有吸湿性。相对分子质量为79.545,密度为6.3~6.9 g/cm,熔点1326℃。不溶于水和乙醇,溶于酸、氯化铵及氰化钾溶液,氨溶液中缓慢溶解,能与强碱反应。氧化铜主要用于制人造丝、陶瓷、釉及搪瓷、电池、石油脱硫剂、杀虫剂,也供制氢、催化剂、绿色玻璃等用。
-

选择特殊符号
选择搜索类型
请输入搜索
氧化铜(CuO)是一种铜的黑色氧化物,略显两性,稍有吸湿性。相对分子质量为79.545,密度为6.3~6.9 g/cm,熔点1326℃。不溶于水和乙醇,溶于酸、氯化铵及氰化钾溶液,氨溶液中缓慢溶解,能与强碱反应。氧化铜主要用于制人造丝、陶瓷、釉及搪瓷、电池、石油脱硫剂、杀虫剂,也供制氢、催化剂、绿色玻璃等用。

密闭操作,局部排风。操作人员必须经过专门培训,严格遵守操作规程。建议操作人员佩戴自吸过滤式防尘口罩,戴化学安全防护眼镜,穿防毒物渗透工作服,戴橡胶手套。避免产生粉尘。避免与还原剂、碱金属接触。搬运时轻装轻卸,防止包装破损。配备泄漏应急处理设备。倒空的容器可能残留有害物。
储存于阴凉、通风的库房。远离火种、热源。应与还原剂、碱金属、食用化学品分开存放,切忌混储。储区应备有合适的材料收容泄漏物。
中国MAC(mg/m³):1[尘],0.2[烟]
TLVTN:烟0.2mg/m³,尘和雾1mg/m³(铜计).
TLVWN:未制定标准
火焰原子吸收光谱法;5-Br-PADAP比色法;催化极谱法
密闭操作,局部排风。
空气中粉尘浓度超标时,必须佩戴自吸过滤式防尘口罩。紧急事态抢救或撤离时,应该佩戴空气呼吸器。
戴化学安全防护眼镜。
穿防渗透工作服。
戴橡胶手套。
及时换洗工作服。注意个人清洁卫生。
外观与性状:黑褐色粉末
熔点(℃):1326(分解。即不可成气态)
相对密度(水=1):6.32(粉末) 溶解性:不溶于水,溶于稀酸,氯化铵和氰化钾。不溶于乙醇。
制人造丝、陶瓷、釉及搪瓷、电池、石油脱硫剂、杀虫剂,也供制氢、催化剂、绿色玻璃等用。实验室制备;铜粉在空气中加热可得 化学方程式;2Cu+O₂====2CuO;在磁性材料生产中用作镍锌铁氧体及热敏元件的原料; 作为有机反应催化剂,制造人造丝和其它铜化合物;制造烟火、触媒、及电镀行业
急性毒性:无急性毒性
LC50:无资料
亚急性和慢性毒性:无资料
刺激性:无资料
致突变性:无致突变性
致畸性:无致畸性
致癌性:无致癌性
生态毒理毒性:无毒
生物降解性:降解较慢或无降解
非生物降解性:自然氧化
生物富集或生物积累性:有一定的积累性
其它有害作用:该物质对环境可能有危害,会对掠鸟、猎鸟、鸣禽以及啮齿动物造成严重的危害。
废弃处置方法:处置前应参阅国家和地方有关法规。用安全掩埋法处置。
危险货物编号:无资料
UN编号:无资料
包装标志:
包装类别:Z01
包装方法:无资料。
运输注意事项:起运时包装要完整,装载应稳妥。运输过程中要确保容器不泄漏、不倒塌、不坠落、不损坏。严禁与还原剂、碱金属、食用化学品等混装混运。运输途中应防曝晒、雨淋,防高温。车辆运输完毕应进行彻底清扫。
化学危险物品安全管理条例(1987年2月17日国务院发布),化学危险物品安全管理条例实施细则 (化劳发[1992] 677号),工作场所安全使用化学品规定 ([1996]劳部发423号)等法规,针对化学危险品的安全使用、生产、储存、运输、装卸等方面均作了相应规定。
还原反应为氧化铜还原成铜的过程
氧化铜(灼热)可以和氢气(H₂)、碳(C)、一氧化碳(CO)等具有还原性物质反应,生成铜+X(氧化物)。
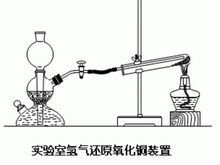
碳还原 用品:试管、单孔塞、酒精灯、铁架台、木炭、氧化铜、石灰水。
操作方法及原理:把经过烘干的木炭粉末和氧化铜粉末混合均匀,小心地铺放进试管,并将试管固定在碳还原氧化铜铁架台上。试管口装有通入澄清石灰水的导管(如图所示),用酒精灯(可加网罩以使火焰集中并提高温度)加热混合物几分钟。然后先撤出导气管,待试管冷却后再把试管里的粉末倒在纸上。观察现象并分析。在这个反应里,氧化铜失去氧而变成单质铜。这种含氧化合物里的氧被夺去的反应,叫做还原反应。其中碳是还原剂。木炭是使氧化铜还原为铜的物质,它具有还原性。单质碳的还原性可用于冶金工业。
现象:黑色粉末逐渐变成光亮的红色,生成气体通入澄清的石灰水后,使澄清石灰水变浑浊,若持续通入,变浑浊的石灰水又会变清。
化学方程式:2CuO+C=2Cu+CO₂(高温)
一氧化碳还原:
用品:铁架台、酒精灯、试管、导管、一氧化碳气体
操作方法:①先通入CO一会儿 ②加热 ③停止加热 ④继续通入CO到玻璃管冷却为止
注:①先通入CO一会儿,是为了防止玻璃管内的空气没有排尽加热时发生爆炸. ②继续通入CO到玻璃管冷却为止,是为了防止生成的铜重新被氧化为氧化铜. 总之:"CO早出晚归酒精灯迟到早退" ,也说"先通后点防爆炸,先熄后停防氧化。" ③用酒精灯点燃是进行尾气处理:防止一氧化碳污染空气 ④此试验 应在通风橱中进行:防止没除净的CO使人中毒
现象:①黑色固体变成红色 ②澄清石灰水变浑浊
化学方程式:CuO+CO=Cu+CO₂(加热/△)
氢气还原:
实验用品锥形瓶、粗铜丝、酒精灯、启普发生器、锌粒、稀硫酸(1∶4)。
实验步骤:
( 1) 在铁架台的立柱上,把粗铜丝绕成如图28所示的螺旋形,置于酒精灯外焰上,高温加热呈红热状态,使铜丝的螺旋部位有足够量的黑色氧化铜生成。
(2) 用锥形瓶(或集气瓶)集满一瓶氢气。把赤热的铜丝从酒精火焰上取出稍冷,让学生观察铜丝外表的黑色氧化铜后,缓慢伸进集满氢气的锥形瓶口,可见铜丝很快变成紫红色;随即取出,铜丝又氧化变黑,再伸进锥形瓶,铜丝又变红,可以如此反复若干次。
现象:①黑色固体表面有红色物质生成;②有小水珠生成
化学方程式:CuO+H₂=Cu+H₂O (加热/△)
制法分为实验室制法和工业生产制法
一、实验室制法
1、利用铜盐如CuSO4与碱(NaOH)反应生成Cu(OH)2 ,再将 Cu(OH)2 加热分解以制得CuO。
CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
Cu(OH)2=△=CuO+H2O
2、加热铜(Cu),使铜与氧气(O2)反应生成氧化铜(CuO)。
2Cu+O2==2CuO
3、氧化铜可由金属铜在空气中加热,或者加热分解氢氧化铜、硝酸铜、碱式碳酸铜 等而制得:
二、工业生产
1、铜粉氧化法
以铜灰、铜渣为原料经焙烧,用煤气加热进行初步氧化,以除去原料中的水分和有机杂质。生成的初级氧化物自然冷却,粉碎后,进行二次氧化,得到粗品氧化铜。粗品氧化铜加入预先装好1:1硫酸的反应器中,在加热搅拌下反应至液体相对密度为原来的1倍,pH值为2~3时即为反应终点,生成硫酸铜溶液,静置澄清后,在加热及搅拌的条件下,加入铁刨花,置换出铜,然后用热水洗涤至无硫酸根和铁质。经离心分离、干燥,在450℃下氧化焙烧8h,冷却后,粉碎至100目,再在氧化炉中氧化,制得氧化铜粉末。
2、硝酸铜热分解法
将电解铜用稀硝酸溶解后在水浴上蒸干,然后在干燥器里要非常缓慢地从90℃加热到120℃。当生成松软的碱式盐时,放入水中煮沸、过滤、干燥;然后将其慢慢加热到400℃,使大部分硝酸除去;接着粉碎后加热到850℃,保持1h,使其分解为氧化铜。为使反应更加完全,可将产品再次粉碎,在约700℃的条件下,加热1h后,放入干燥器中冷却。
3.碳酸铜热分解法
将铜粉或铜线在通风橱内用尽可能少的6mol/L硝酸使其完全溶解,如果溶液不透明,则需过滤。另将碳酸钠配成溶液与上述硝酸铜溶液混合、煮沸生成黑色的碱式盐沉淀。当固体沉降后舍去上层清液,用倾析法充分洗涤、过滤、干燥。将其放于蒸发皿上,在充分搅拌下用小火加热,使其分解为氧化铜。
4.铜丝或铜粉硝化
将铜丝或铜粉溶于6mol/L硝酸中保持铜稍过量,加热至溶液pH值3~4,以除去氢氧化铁沉淀,然后与10%( 质量)的碳酸钠溶液混合,加热沸腾,有碱式盐析出,弃去上层清液,用水充分洗涤、过滤、干燥。将干燥的碱式碳酸铜在充分搅拌下于小火加热分解为黑色氧化铜粉末:CuCO3·Cu(OH)2=2CuO+CO2↑+H2O
当不再有二氧化碳生成,表明分解完全。
5.电导水溶解法
用电导水溶解高纯硝酸铜,过滤,在清液中加入过量高纯NH3·H2O,滤去杂质沉淀,滤液用高纯硝酸中和至氢氧化铜析出。过滤,用电导水洗涤一次,再加硝酸溶解沉淀,加高纯碳酸铵析出碳酸铜,再洗涤,甩干,在200℃烘箱内烘干后,于450~550℃灼烧3~4h,得光谱纯氧化铜:
化学口诀
三分之一适研钵,先慢后快圆周磨。
火碱宜用饱和液,全部变黑方停做。
相关解释
1.三分之一适研钵:意思是说每次研磨时所装药品不能超过研钵容积的1/3(装多了不仅研磨时洒出来,而且降低研磨细度和速率)
2.先慢后快圆周磨:意思是说研磨时杵头要压在研钵体上,始终作圆周运动,开始时速度要慢,随着药品的破碎程度增大,可以适当加快研磨速度。
3.火碱宜用饱和液:意思是说,为了减少溶液的体积,最好用饱和的NaOH溶液。
4.全部变黑方停做:意思是说,直到全部变成了黑色固体时才停止加热
S22Do not breathe dust.
切勿吸入粉尘。
R22Harmful if swallowed.
吞食有害。
储存:储存于阴凉、通风的库房。远离火种、热源。应与还原剂 、碱金属 、食用化学品分开存放,切忌混储。储区应备有合适的材料收容泄漏物。
运输:起运时包装要完整,装载应稳妥。运输过程中要确保容器不泄漏、不倒塌、不坠落、不损坏。严禁与还原剂、碱金属、食用化学品等混装混运。运输途中应防曝晒、雨淋,防高温。车辆运输完毕应进行彻底清扫。
气体分析中测定碳。有机反应催化剂。制造人造丝和其他铜化合物。光学玻璃发光剂。作为色料用于人造宝石、有色玻璃、陶瓷釉彩。
用作玻璃、瓷器的着色剂,油类的脱硫剂、氢化剂,有机合成催化剂,还用于人造丝的制造、气体分析等;
用作分析试剂(定氮用)、氧化剂、催化剂;用作玻璃、搪瓷、陶瓷工业的着色剂,油漆的防皱剂,光学玻璃的磨光剂。
用于制造染料、有机催化剂载体以及铜化合物。还用于人造丝制造工业及油脂的脱硫剂。用作其他铜盐制造的原料,也是制人造宝石的原料。
用作玻璃、瓷器的颜料、脱硫剂、催化剂,还用于人造丝工业;用于有机化合物中测定碳;用作分析试剂、氧化剂、催化剂和石油脱硫剂;用作玻璃、搪瓷、陶瓷工业的着色剂,油漆的防邹剂,光学玻璃的磨光剂。
危险性
健康危害:误服或吸入大量氧化铜粉尘可能引起金属烟热,出现寒颤、体温升高,同时可伴有呼吸道刺激症状。长期接触,可能引起呼吸道及眼结膜刺激、鼻衄、鼻粘膜出血点或溃疡,甚至鼻中隔穿孔以及皮炎(以上病理反应未经证实)。燃爆危险:该品不燃,属于无气味呈黑褐色稳定性物质。cuo i5 2300好还是i5 760好或者价格差不多的CPU性比价高的介绍个
2300默认比760强,760超频性能比2300好。所以你不超频的话,普通用户用2300比较好,毕竟是新一代的U。超频玩家用760更好点。
C,H2 ,CO还原氧化铜吸热
谣言实例:C+ 2CuO = 高温= 2Cu + CO2↑吸热反应
辟谣:判断反应热效应的两个标准是实验实测以及通过热力学进行计算
计算过程:
反应1:CuO(s)+H2(g)=Cu(cr)+H2O(g)
反应2:CuO(s)+CO(g)=Cu(cr)+CO2(g)
反应3:CuO(s)+1/2C(石墨)=Cu(cr)+1/2CO2(g)
计算化学反应热效应可以直接使用ΔH(例题见高等教育出版社《无机化学》上册216页),此处忽略温度对ΔH的影响。
相应物质标准生成焓:(单位:kJ/mol)(数据出自高等教育出版社《无机化学》上册427页起的附表)
| 分子式 | 标准生成焓 |
| H2O(g) | -241.82 |
| C(石墨) | 0.00 |
| H2(g) | 0.00 |
| CO(g) | -110.53 |
| CO2(g) | -393.51 |
| Cu(s) | 0.00 |
| CuO(cr) | -157.30 |
数据代入计算可知:
ΔH1=0+(-241.818)-(-157.3)-(0)=-84.518<0,即反应放热
ΔH2=0+(-393.509)-(-110.525)-(-157.3)=-125.684<0,即反应放热
ΔH3=0.5×(-393.509)+0-(-157.3)-0=-39.455<0,即反应放热
综上可证这三个反应都是放热反应,即网络上流传的所谓"C,H2,CO还原氧化铜(吸热)"实质系谣言

 CuO纳米颗粒在CuO-R113纳米制冷剂沸腾过程中迁移量的实验测定
CuO纳米颗粒在CuO-R113纳米制冷剂沸腾过程中迁移量的实验测定
CuO纳米颗粒在CuO-R113纳米制冷剂沸腾过程中迁移量的实验测定
CuO纳米颗粒在CuO-R113纳米制冷剂沸腾过程中迁移量的实验测定——实验测定了有油和无油工况下,cu0纳米颗粒在cuo—R113纳米制冷剂沸腾过程中的迁移量。结果表明:在cuo-Rl13纳米制冷剂沸腾过程中无论是有油还是无油,cu0纳米颗粒的迁移量都随Cu0纳米颗粒质量和...

 堇青石蜂窝陶瓷载CuO选择催化还原NO的研究
堇青石蜂窝陶瓷载CuO选择催化还原NO的研究
堇青石蜂窝陶瓷载CuO选择催化还原NO的研究
以堇青石蜂窝陶瓷(CC)为载体、CuO和不同助剂为活性组分,用浸渍法制备CuO/CC、CuO-NiO/CC和CuO-NiO-CeO2/CC催化剂,采用TPR、XRD和XPS等测试方法对催化剂进行表征。TPR结果表明,催化剂主要以Cu2+形式存在。采用程序升温和恒温法在固定床反应器常压条件下研究了以尿素作还原剂还原模拟汽车尾气中的NO。结果显示,CuO-NiO-CeO2/CC催化剂在(150~350)℃具有较高的活性,250℃时具有较高的转化率。
C,H2 ,CO还原氧化铜吸热
谣言实例:C+ 2CuO = 高温= 2Cu + CO2↑吸热反应
辟谣:判断反应热效应的两个标准是实验实测以及通过热力学进行计算
计算过程:
反应1:CuO(s)+H2(g)=Cu(cr)+H2O(g)
反应2:CuO(s)+CO(g)=Cu(cr)+CO2(g)
反应3:CuO(s)+1/2C(石墨)=Cu(cr)+1/2CO2(g)
计算化学反应热效应可以直接使用ΔH(例题见高等教育出版社《无机化学》上册216页),此处忽略温度对ΔH的影响。
相应物质标准生成焓:(单位:kJ/mol)(数据出自高等教育出版社《无机化学》上册427页起的附表)
| 分子式 | 标准生成焓 |
| H2O(g) | -241.82 |
| C(石墨) | 0.00 |
| H2(g) | 0.00 |
| CO(g) | -110.53 |
| CO2(g) | -393.51 |
| Cu(s) | 0.00 |
| CuO(cr) | -157.30 |
数据代入计算可知:
ΔH1=0+(-241.818)-(-157.3)-(0)=-84.518<0,即反应放热
ΔH2=0+(-393.509)-(-110.525)-(-157.3)=-125.684<0,即反应放热
ΔH3=0.5×(-393.509)+0-(-157.3)-0=-39.455<0,即反应放热
综上可证这三个反应都是放热反应,即网络上流传的所谓"C,H2,CO还原氧化铜(吸热)"实质系谣言
由异丁醇的蒸气在350~400℃和压力下通过(CuO+A12O3)、(ZnO+A12O3)或(CuO+ZnO+A12O3)催化柱而得。
精制方法:碳酸钾或无水硫酸钠干燥后蒸馏。
(1)活泼的金属单质(如钠,镁,铝,等)
(2)某些非金属单质(如H2 、C等)、非金属阴离子及其化合物、低价金属离子(如Fe2+)等 还原剂实验举例:氢气还原氧化铜、氧化铁(H2+CuO=Cu+H2O ; 3H2+Fe2O3=2Fe+3H2O); 炭还原氧化铜(C+2CuO=2Cu+CO2); 一氧化碳还原氧化铜、氧化铁(CO+CuO=Cu+CO2 ; 3CO+Fe2O3=2Fe+3CO2)
蓝绿色单斜结晶或颗粒。无气味。在干燥空气中风化。在潮湿空气中表面氧化成棕色的碱式硫酸铁。在56.6℃成为四水合物,在65℃时成为一水合物。溶于水,几乎不溶于乙醇。其水溶液冷时在空气中缓慢氧化,在热时较快氧化。加入碱或露光能加速其氧化。相对密度(d15)1.897。半数致死量(小鼠,经口)1520mG/kG。有刺激性。无水硫酸亚铁是白色粉末,含结晶水的是浅绿色晶体,晶体俗称"绿矾",溶于水水溶液为浅绿色。用于色谱分析试剂。点滴分析测定铂、硒、亚硝酸盐和硝酸盐。还原剂。制造铁氧体。净水。聚合催化剂。照相制版。
硫酸亚铁的还原原理
大量的硫酸亚铁被用作还原剂,主要还原水泥中的铬酸盐。
含六价铬废水一般采用铬还原法进行处理。
原理:在酸性条件下,投加还原剂硫酸亚铁、亚硫酸钠、亚硫酸氢钠、二氧化硫等,将六价铬还原成三价铬,然后投加氢氧化钠、氢氧化钙、石灰等调pH值,使其生成三价铬氢氧化物沉淀从废水中分离。
在该反应中,氧化剂是Cl2,还原剂也是Cl2,本反应是歧化反应。
氯气遇水会产生次氯酸,次氯酸具有净化作用,用于消毒--溶于水生成的HClO具有强氧化性
化学方程式是: Cl2+H2O=HCl+HClO(可逆反应)
氯气与碱溶液反应
【例】
Cl2+2NaOH=NaCl+NaClO+H2O
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
上述两反应中,Cl2作氧化剂和还原剂,是歧化反应。
Cl2 + 2OH(-) (冷) = ClO(-) + Cl(-) + H2O
3Cl2 + 6OH(-) (热) = ClO3(-) + 5Cl(-) + 处理工艺流程:含Cr6+废水→调节池→还原反应池→混凝反应池→沉淀池→过滤器→pH回调池→排放。
氯气常温常压下为黄绿色气体,经压缩可液化为金黄色液态氯,是氯碱工业的主要产品之一,用作为强氧化剂与氯化剂。氯混合 5%(体积)以上氢气时有爆炸危险。氯能与有机物和无机物进行取代或加成反应生成多种氯化物。氯在早期作为造纸、纺织工业的漂白剂。
活泼的金属单质:如Na,Al,Zn,Fe等.
活泼的金属氢化物:如氢化铝锂LiAlH4
某些非金属单质:如H2,C,Si等.元素(如C,S等)
碱金属单质:如Li,Na,K等
处于低化合价时的氧化物:如CO,SO2,H2O2等。
非金属氢化物:如H2S,NH3,HCl,CH4等。
处于低化合价时的盐:如Na2SO3,FeSO4等。
氯化亚锡SnCl2,草酸H2C2O4,硼氢化钾KBH4,硼氢化钠NaBH4,乙醇C2H5OH