选择特殊符号
选择搜索类型
请输入搜索
可溶性碳酸盐污染wlu6lc carbonates cnnt}micisrlior,钻 井作业中钻井液受到可溶性碳酸th的污染。例如钻5 C'C)} 地层时,C:C7}将与钻井液中的碱性物质反应生成HC f7;及 (.`f J犷;钻井液中有机物的分解,细菌的活动,不纯的玉晶石等 也能产生I-1C'f);及C'U一;纯碱或小苏打处理过厦,也能使钻 井液受到碳酸r*rrr}' i }染二}CCy污染使切力和动切力3卜高,但 。日值降低;CO是使切力、动切力及zH值均升l高-
在碳酸盐中,纯碱(碳酸钠)是重要的化工原料,广泛应用于化工、玻璃、肥皂、造纸、纺织和食品等工业。钾碱(碳酸钾)是玻璃生产的主要原料。小苏打(碳酸氢钠)广泛用于医药和食品工业,也常用于制造灭火器。石灰石...
碱金属和碱土金属碳酸盐显碱性。碳酸铵显中性。
不能溶于水的碳酸盐显中性;能溶于水的碳酸盐中,如果是强碱与碳酸生成的盐就显碱性,如:碳酸钠、碳酸钾等强碱弱酸盐,只有碳酸根离子水解,所以显碱性。CO32-+H2O=HCO3-+OH-(可逆)HCO3-...
碳酸盐和酸式碳酸盐大多数为无色的。碱金属和铵的碳酸盐易溶于水,其他金属的碳酸盐都难溶于水。碳酸氢钠在水中的溶解度较小,其他酸式碳酸盐都易溶于水。碱式碳酸盐一般难溶于水。
关于碳酸盐在水中的溶解性,一般来说,碳酸盐难溶的金属,碳酸氢盐溶解度相对较大;而碳酸盐易溶的金属,碳酸氢盐的溶解度则明显减小。普遍认为是HCO3-离子在溶液中形成了氢键相互缔合,使溶解度减小的缘故。可溶性碳酸盐在水溶液中都会水解,使溶液呈碱性。如0.1Μ碳酸钠溶液的pH为11.6,其溶液中存在分步水解平衡:
其中第一步水解是主要的。对于碱金属的酸式碳酸盐来说,第二步是主要的,但水解程度远小于第一步。另外,HCO婣还要电离。因而0.1Μ碳酸氢钠水溶液呈弱碱性,pH为8.3。
难溶于水的碳酸盐都能溶于稀的强酸、乙酸或二氧化碳的饱和溶液中,例如: 碳酸盐在加热时都会分解成金属氧化物并放出二氧化碳,此反应为非氧化还原反应。(对于碳酸银,加热后由于Ag2O不稳定,即分解为单质银和氧气。)不同碳酸盐的热稳定性差异很大。其中碱金属和碱土金属碳酸盐的热稳定性较高,必须灼烧至高温才分解;而有些金属的碳酸盐的热稳性较低,加热到100℃左右就分解,如碳酸铍等;有的碳酸盐在常温下就可以分解,如碳酸汞。酸式碳酸盐的热稳定性比相同金属的碳酸盐低得多。例如碳酸钠,要851℃以上才开始分解,而碳酸氢钠在270℃左右就明显分解:
酸式碳酸盐的溶液在常温下会缓慢放出CO2而分解。
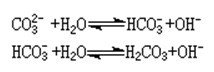
碳酸盐的制备方法有以下四种:
①氨碱法:
② 碱吸收二氧化碳法:
2NaOH+CO2─→Na2CO3+H2O
2NH3+CO2+H2O─→(NH4)2CO3
③ 可溶性碳酸盐沉淀难溶碳酸盐法:
Na2CO3+CaCl2─→CaCO3+2NaCl
④ 酸式碳酸盐热分解沉淀法:
'
酸式碳酸盐通常可用碳酸盐进一步吸收二氧化碳的反应制备:
Na2CO3+CO2+H2O─→2NaHCO3
也可用碱吸收过量二氧化碳制备:
KOH+CO2─→KHCO3
NH3+H2O+CO2─→NH4HCO3
此外,难溶的碱式碳酸盐可由某些金属的可溶性盐类溶液中加入碱金属碳酸盐溶液来制备:
式中M为Be、Mg、Cu等。
应用 在碳酸盐中,纯碱(碳酸钠)是重要的化工原料,广泛应用于化工、玻璃、肥皂、造纸、纺织和食品等工业。钾碱(碳酸钾)是玻璃生产的主要原料。小苏打(碳酸氢钠)广泛用于医药和食品工业,也常用于制造灭火器。石灰石、大理石、白云石可用于建筑、水泥和钢铁等工业。
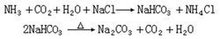
碳酸盐是金属元素阳离子和碳酸根相化合而成的盐类。碳酸盐矿物的种数在95种左右,其中白云石是在自然界分布极广的矿物,而且不少碳酸盐矿物是重要的非金属矿物原料,也是提取Fe,Mg,Mn,Cu等金属元素及放射性元素Th、U的重要矿物来源,具有重要的经济意义。 在碳酸盐矿物中,主要的阴离子为[CO3]2-,阳离子主 要是Ca2+、Mg2+,其次Na+、Fe2+以及Cu2+、Zn2+、Pb2+、Mn2+、Bi3+等。一些碳酸盐矿物具有完好的单晶体,也可呈块状、粒状、放射状和土状等集合体形态。 碳酸盐矿物大多数为无色或白色,含铜者呈鲜绿或鲜蓝色,含锰者呈玫瑰红色,含稀土者或铁者呈褐色,含钴者呈淡红色,含铀者呈黄色。矿物硬度不大,一般在3左右。最大的是稀土碳酸盐矿物的硬度,但也不超过4.5,非金属光泽为主。碳酸盐矿物主要为外生成因,分布广泛,可形成大面积分布的海相沉积地层。内生成因的碳酸盐岩多数出现在岩浆热液阶段。
