第1章绪论1
1.1范畴1
1.2沿革与发展2
1.3课程内容3
1.4应用与教学目的4
1.4.1学科位置与应用4
1.4.2教学目的4
1.5学习辅助资料5
第2章流体的pVT关系7
2.1单组分流体的pVT行为7
2.2均相流体pVT行为的模型化11
2.2.1状态方程与不可压缩流体11
2.2.2气体的非理想性及其修正13
2.3单组分的汽液相平衡的模型:蒸气压方程16
2.4virial方程18
2.4.1方程基本形式18
2.4.2舍项方程18
2.4.3virial系数的获取18
2.5立方型状态方程20
2.5.1van der Waals方程20
2.5.2几种常用的立方型状态方程及其普适形式21
2.5.3立方型方程参数的决定21
2.5.4立方型方程根的特征23
2.5.5汽相及类似汽相体积的根24
2.5.6液相及类似液相体积的根24
2.6状态方程的普遍化关联26
2.6.1Pitzer的三参数普遍化关联式与Edmister的压缩因子图26
2.6.2LeeKesler方程27
2.6.3普遍化的第二virial系数28
2.7状态方程的选用31
2.8饱和液体的体积关联式34
2.9气体混合物的pVT关系37
2.9.1虚拟临界性质与Kay规则37
2.9.2状态方程的混合规则与相互作用参数39
2.9.3泡点下的液体混合物密度42
第3章流体的热力学性质:焓与熵44
3.1纯流体的热力学关系44
3.1.1基本关系式44
3.1.2焓和熵表示为T及p的函数46
3.1.3Gibbs函数作为基本运算的函数48
3.2热容、蒸发焓与蒸发熵49
3.2.1理想气体的热容49
3.2.2液体的热容49
3.2.3蒸发焓与蒸发熵49
3.3剩余性质51
3.4以状态方程计算剩余性质54
3.4.1利用virial方程求MR54
3.4.2利用立方型方程求MR56
3.4.3利用LeeKesler关联式求MR58
3.5纯流体的焓变与熵变的计算62
3.6热力学性质图和表65
3.6.1类型与构成65
3.6.2热力学性质图绘制原理66
3.6.3水蒸气表67
3.7多组分流体的热力学关系68
3.8偏摩尔性质及其与流体性质关系71
3.8.1偏摩尔性质的加成关系71
3.8.2偏摩尔性质间的关系72
3.8.3偏摩尔性质的计算73
3.8.4GibbsDuhem方程76
3.9混合性质与多组分流体性质78
3.9.1理想混合物78
3.9.2混合性质79
3.10多组分流体焓变与熵变的计算82
3.10.1焓变与熵变的计算基本公式82
3.10.2焓浓图84
第4章能量利用过程与循环87
4.1热力学第一定律与能量平衡方程87
4.1.1开放体系的质量平衡87
4.1.2能量平衡的一般式88
4.1.3稳流体系的能量平衡90
4.1.4测量焓的流动卡计91
4.1.5焓变的应用92
4.2流体压缩与膨胀96
4.2.1气体压缩96
4.2.2流体膨胀99
4.3动力循环100
4.3.1蒸汽动力循环101
4.3.2燃气动力循环105
4.3.3联合动力循环108
4.4制冷与热泵109
4.4.1Carnot制冷循环109
4.4.2蒸气压缩制冷循环110
4.4.3制冷剂的选择112
4.4.4吸收式制冷113
4.4.5热泵115
4.5液化过程116
第5章过程热力学分析120
5.1热力学第二定律与熵平衡方程120
5.1.1熵产生与熵平衡方程120
5.1.2能量质量的差异122
5.2函数123
5.2.1的概念123
5.2.2环境参考态125
5.2.3功和热的127
5.2.4物质的标准127
5.2.5稳定流动体系的129
5.3平衡方程132
5.3.1损失与稳流系的平衡方程132
5.3.2效率134
5.4过程与系统的分析136
5.4.1“过程体系”的分析方法136
5.4.2“状态体系”的分析方法139
第6章流体热力学性质:逸度与活度142
6.1逸度142
6.1.1纯组分的逸度142
6.1.2纯组分汽液相平衡时的逸度143
6.1.3多组分体系中组分的逸度144
6.1.4LewisRandall规则145
6.1.5剩余性质的基本关系145
6.2逸度的计算146
6.2.1气体纯组分逸度的计算146
6.2.2液体纯组分逸度的计算149
6.2.3多组分体系逸度的计算151
6.3活度156
6.3.1纯液体与固体组分的活度156
6.3.2液态多组分体系中的组分的活度157
6.3.3活度与混合性质160
6.4超额性质161
6.4.1超额Gibbs函数161
6.4.2超额Gibbs函数与活度系数163
6.4.3超额性质的本质164
6.5活度系数模型166
6.5.1Scatchard Hildebrand方程与溶解度参数166
6.5.2RedlichKister经验式167
6.5.3Margules模型168
6.5.4van Laar模型169
6.5.5局部组成模型169
6.5.6活度系数模型的选用171
第7章流体相平衡177
7.1稳定性准则177
7.2汽液相平衡的相图180
7.3汽液相平衡模型化186
7.3.1平衡判据186
7.3.2汽液相平衡基本关系式186
7.3.3De Priester列线图与K值关联汽液相平衡188
7.3.4溶液体系的汽液相平衡关系189
7.4汽液相平衡的基本计算192
7.4.1露点和泡点的计算192
7.4.2闪蒸的计算199
7.5互溶系的共沸现象204
7.6热力学一致性检验206
7.7液液相平衡209
7.7.1.液液相平衡相图209
7.7.2液液相平衡的模型化212
第8章化学平衡214
8.1化学平衡模型化方法214
8.1.1反应进度214
8.1.2反应体系的独立反应数217
8.1.3化学平衡判据219
8.1.4平衡常数220
8.2气相单一反应平衡225
8.3气相多个反应平衡230
8.4液相反应平衡234
8.4.1液体混合物反应平衡234
8.4.2溶液反应平衡235
8.5非均相反应平衡237
8.5.1气固相反应平衡237
8.5.2气液相反应平衡240
思考题与习题245
附录258
A1单位换算表258
A2气体常数表258
B1纯物质的热力学性质258
B2LeeKesler方程的压缩因子的分项值Z0和Z1264
B3LeeKesler方程的剩余性质焓的分项值(HR)0/RTc和(HR)1/RTc268
B4LeeKesler方程的剩余性质熵的分项值(SR)0/R和(SR)1/R272
B5LeeKesler方程的逸度系数的分项值0和1276
B6热力学性质关系表(Brigeman表)280
B7水蒸气表281
B71水蒸气表:饱和水及其饱和蒸汽(以温度为序)283
B72水蒸气表:饱和水及其饱和蒸汽(以压力为序)284
B73水蒸气表:过热水蒸气285
B74水蒸气表:过冷水288
B8HFC134a的饱和液体与饱和蒸气的热力学性质289
B9化学元素的基准物和标准290
B10部分物质的相互作用参数291
C1空气的温熵图292
C2水蒸气的温熵图293
C3氨的压焓图294
C4 HFC134a的压焓图295
C5水蒸气的焓熵图296
C6H2SO4H2O的焓浓图297
参考文献298 2100433B

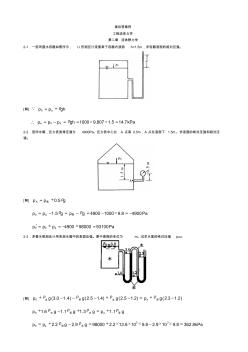 工程流体力学第二版答案
工程流体力学第二版答案

 工程流体力学课后习题集答案解析(第二版)
工程流体力学课后习题集答案解析(第二版)