氯碱工业
工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业。氯碱工业是最基本的化学工业之一,它的产品除应用于化学工业本身外,还广泛应用于轻工业、纺织工业、冶金工业、石油化学工业以及公用事业。
-

选择特殊符号
选择搜索类型
请输入搜索
工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业。氯碱工业是最基本的化学工业之一,它的产品除应用于化学工业本身外,还广泛应用于轻工业、纺织工业、冶金工业、石油化学工业以及公用事业。

1.工业盐
2.电石(也叫煤石,对于电石法生产PVC而言)
3.氯乙烯单体(VCM单体,对于石油法提取单体生产PVC而言)
4.其他聚合助剂
阳极反应:2Cl--2e-=Cl2↑(氧化反应)
H+比Na+容易得到电子,因而H+不断地从阴极获得电子被还原为氢原子,并结合成氢分子从阴极放出。
阴极反应:2H++2e-=H2↑(还原反应)
在上述反应中,H+是由水的电离生成的,由于H+在阴极上不断得到电子而生成H2放出,破坏了附近的水的电离平衡,水分子继续电离出H+和OH-,H+又不断得到电子变成H2,结果在阴极区溶液里OH-的浓度相对地增大,使酚酞试液变红。因此,电解饱和食盐水的总反应可以表示为:
2NaCl+2H2O=2NaOH+Cl2↑+H2↑
工业上利用这一反应原理,制取烧碱、氯气和氢气。
在上面的电解饱和食盐水的实验中,电解产物之间能够发生化学反应,如NaOH溶液和Cl2能反应生成NaClO、H2和Cl2混合遇火能发生爆炸。在工业生产中,要避免这几种产物混合,常使反应在特殊的电解槽中进行。生产原理及工艺 由电解食盐水溶液制取烧碱、氯气和氢气的工业生产,是重要的基础化学工业之一。我国的氯碱工业主要采用两种生产工艺。
1.32%氢氧化钠
2.50%氢氧化钠
3.固体氢氧化钠(片碱)
4.高纯盐酸
5.工业盐酸
6.次氯酸钠
7.氯气、液氯(液态氯气)
8.PVC(聚氯乙烯树脂,氯碱工业一般都伴随PVC树脂)
9.氢气
工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业。氯碱工业是最基本的化学工业之一,它的产品除应用于化学工业本身外,还广泛应用于轻工业、纺织...
离子交换树脂是一类具有离子交换功能的高分子材料。在溶液中它能将本身的离子与溶液中的同号离子进行交换。按交换基团性质的不同,离子交换树脂可分为阳离子交换树脂和阴离子交换树脂两类。 阳离子交换树脂大都含有...
为什么氯碱工业中用阳离子交换膜? 不用阴离子? 不用交换膜不行?
首先我们要明白离子交换膜的作用,是为了阻碍某种离子的通过,另外一种离子可以通过的膜,然后为什么要用呢,发现,如果我们不用,得到的产物不纯,有氯化钠,作用是防止氯离子通过要让钠离子去阴极,和氢氧根形成氢...
我国氯碱工业的发展
我国最早的氯碱工厂是1930年投产的上海天原电化厂(现上海天原化工厂的前身),日产烧碱2t。到1949年解放时,全国只有少数几家氯碱厂,烧碱年产量仅1.5万吨,氯产品只有盐酸、液氯、漂白粉等几种。
从20世纪末开始,我国的氯碱工业在产量、质量、品种、生产技术等方面都得到很大发展。到1990年,烧碱产量达331万吨,仅次于美国和日本,位于世界第三位。1995年,烧碱产量达496万吨,其中用离子交换膜电解法生产的达56.2万吨,占总产量的11.3%。预计到2000年,烧碱年产量将达540万吨,其中用离子膜电解法生产的将达180万吨,占33.3%。
以氯碱工业为基础的化工生产
NaOH、Cl2和H2都是重要的化工生产原料,可以进一步加工成多种化工产品,广泛用于各工业。所以氯碱工业及相关产品几乎涉及国民经济及人民生活的各个领域。
由电解槽流出的阴极液中含有30%的NaOH,称为液碱,液碱经蒸发、结晶可以得到固碱。阴极区的另一产物湿氢气经冷却、洗涤、压缩后被送往氢气贮柜。阳极区产物湿氯气经冷却、干燥、净化、压缩后可得到液氯。
2NaOH+Cl2= NaCl+NaClO+H2O
H2O+Cl2=HCl+HClO
H2+Cl2=2HCl
2NaOH+CO2=Na2CO3(苏打)+H2O
NaOH+CO2=NaHCO3(小苏打)
随着人们环境保护意识的增强,对以氯碱工业为基础的化工生产过程中所造成的污染及其产品对环境造成的影响越来越重视。例如,现已查明某些有机氯溶剂有致癌作用,氟氯烃会破坏臭氧层等,因此已停止生产某些有机氯产品的措施。我们在充分发挥氯碱工业及以氯碱工业为基础的化工生产在国民经济发展中的作用的同时,应尽量减小其对环境的不利影响。
1.隔膜法
电解在立式隔膜电解槽中进行,如图 a所示。电解槽的阳极用涂有tiO 2 - RuO 2 涂层的钛或石墨制成,阴极由铁丝网制成,网上附着一层石棉绒做隔膜,这层隔膜把电解槽分隔成阳极室和阴极室。将已除去Ca 2+ 、Mg2+ 、
下两种电离方程:
NaCl =Na+ + Cl-
H2O= (可逆)H+ + OH-
所以,食盐水中含有Na+ 、H+ 、Cl- 和OH- 四种离子。当接通电源后,在电场的作用下,带负电的Cl-和 OH- 移向阳极,带正电的Na+和H+移向阴极,在这种条件下,电极上发生如下反应:
在阳极 2Cl - - 2e= Cl 2 ↑
在阴极 2H + + 2e=H 2 ↑
即在阳极室放出 Cl 2 ,阴极室放出 H 2。由于阴极上有隔膜,而且阳极室的液位比阴极室高,所以可以阻止 H 2 跟 Cl 2 混合,以免引起爆炸。由于H+不断放电,破坏了水的电离平衡,促使水不断电离,造成溶液中 OH - 的富集。这样在阴极室就形成了NaOH溶液,它从阴极室底部流出。电解食盐水的总反应可以表示如下:
2NaCl+2H2O= 2NaOH+H 2 ↑+ Cl 2 ↑
用这种方法生产的碱液比较稀,其中含有多量未电解的NaCl,需要经过分离、浓缩,才能得到固态NaOH。
离子交换膜法制烧碱
世界上比较先进的电解制碱技术是离子交换膜法。这一技术在20世纪50年代开始研究,80年代开始工业化生产。
离子交换膜电解槽主要由阳极、阴极、离子交换膜、电解槽框和导电铜棒等组成,每台电解槽由若干个单元槽串联或并联组成。右图表示的是一个单元槽的示意图。电解槽的阳极用金属钛网制成,为了延长电极使用寿命和提高电解效率,钛阳极网上涂有钛、钌等氧化物涂层;阴极由碳钢网制成,上面涂有镍涂层;阳离子交换膜把电解槽隔成阴极室和阳极室。阳离子交换膜有一种特殊的性质,即它只允许阳离子通过,而阻止阴离子和气体通过,也就是说只允许Na+通过,而Cl-、OH-和气体则不能通过。这样既能防止阴极产生的H2和阳极产生的Cl2相混合而引起爆炸,又能避免Cl2和NaOH溶液作用生成NaClO而影响烧碱的质量。下图是一台离子交换膜电解槽(包括16个单元槽)。
精制的饱和食盐水进入阳极室;纯水(加入一定量的NaOH溶液)加入阴极室。通电时,H2O在阴极表面放电生成H2,Na+穿过离子膜由阳极室进入阴极室,导出的阴极液中含有NaOH;Cl-则在阳极表面放电生成Cl2。电解后的淡盐水从阳极导出,可重新用于配制食盐水。
离子交换膜法电解制碱的主要生产流程可以简单表示如下图所示:
电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙,
精制食盐水时经常进行以下措施
(1)过滤海水
(2)加入过量氢氧化钠,去除钙、镁离子,过滤
Ca(2+)+2OH(-)=Ca(OH)2(微溶)
① Mg(2+)+2OH(-)=Mg(OH)2↓
② Mg(HCO3)2+2OH(-)=MgCO3+2H2O
MgCO3+2H2O=Mg(OH)2+H2O+CO2
(3)加入过量氯化钡,去除硫酸根离子,过滤
Ba(2+)+SO4(2-)=BaSO4↓
(4)加入过量碳酸钠,去除钙离子、过量钡离子,过滤
Ca(2+)+CO3(2-)=CaCO3↓
Ba(2+)+CO3(2-)=BaCO3↓
(5)加入适量盐酸,去除过量碳酸根离子
2H(+)+CO3(2-)=CO2↑+H2O
(6)加热驱除二氧化碳
(7)送入离子交换塔,进一步去除钙、镁离子
(8)电解
2NaCl+2H2O=(通电)H2↑+Cl2↑+2NaOH
离子交换膜法制碱技术,具有设备占地面积小、能连续生产、生产能力大、产品质量高、能适应电流波动、能耗低、污染小等优点,是氯碱工业发展的方向。

 论氯碱工业的腐蚀与防护
论氯碱工业的腐蚀与防护
论氯碱工业的腐蚀与防护
论氯碱工业的腐蚀与防护 【摘 要】在氯碱工业中,所用到的氯气、烧碱、盐酸都非常具 有腐蚀性,在使用氯气前,做好氯碱装置的防腐工作是氯碱工业的 重要目标,也是整个氯碱工业安全运行的关键。本文从实际出发, 对氯碱生产中的防腐和保护做出进一步分析。 【关键词】氯碱工业;防腐;保护 一、氯碱工业的腐蚀特点 (1)对碳钢的腐蚀。被腐蚀电池电极反应出来的结果,就是碳 钢在碱性盐水溶液中所受到的腐蚀。当碳钢在食盐水中时,会产生 出可溶性的化合物,这使得腐蚀加快,阳性反应让金属变成 fe2+, 进入盐水溶液中, 阴性反应则为 4e+2h2o+o2。对有氧的饱和盐水而 言,在液面处腐蚀,因为有氧气,阴性反应生成 oh,盐水靠近液面 的液相部分,使金属溶解成 fe2+,生成氢氧化亚铁,再氧化成 fe3+, 这样就产生了铁锈。饱和水对碳钢的腐蚀和盐水的温度、氧的扩散 等原因有直接关系,所以,在流动和搅拌过程中的

 抓好信息化建设 促进氯碱工业发展
抓好信息化建设 促进氯碱工业发展
抓好信息化建设 促进氯碱工业发展
介绍了信息化技术在产品研发、生产经营、企业管理等环节中的应用。信息化技术成为提升企业管理水平和核心竞争力的必要条件,信息化建设是实现产业升级的重要步骤。
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
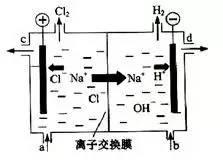
完成下列填空:
(1)写出电解饱和食盐水的离子方程式。
(2)离子交换膜的作用为:、。
(3)精制饱和食盐水从图中 位置补充,氢氧化钠溶液从图中位置流出。(选填“a”、“b”、“c”或“d”)
(4)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。
写出该反应的化学方程式。
(5)室温下,0.1 mol/L NaClO溶液的pH0.1 mol/L Na2SO3溶液的pH。(选填“大于”、“小于”或“等于”)。浓度均为0.1 mol/L 的Na2SO3和Na2CO3的混合溶液中,SO32–、CO32–、HSO3–、HCO3– 浓度从大到小的顺序为。
已知:
H2SO3 Ki1=1.54×10-2 Ki2=1.02×10-7
HClO Ki1=2.95×10-8
H2CO3 Ki1=4.3×10-7 Ki2=5.6×10-11
试题解析
(1)电解饱和食盐水时,溶液中的阳离子H+在阴极得到电子变为H2逸出,使附近的水溶液显碱性,溶液中的阴离子Cl-在阳极失去电子,发生氧化反应。产生Cl2。反应的离子方程式是2Cl-+2H2OCl2↑+H2↑+2OH-。
(2)图中的离子交换膜只允许阳离子通,是阳离子交换膜,可以允许阳离子通过,不能使阴离子通过,这样就可以阻止阴极溶液中的OH-进入阳极室,与氯气发生反应,阻止Cl-进入阴极室,使在阴极区产生的NaOH纯度更高。同时可以阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸。
(3)随着电解的进行,溶质NaCl不断消耗,所以应该及时补充。精制饱和食盐水从与阳极连接的图中a位置补充,由于阴极H+不断放电,附近的溶液显碱性,氢氧化钠溶液从图中d位置流出;水不断消耗,所以从b口不断加入蒸馏水,从c位置流出的是稀的NaCl溶液。
(4)KClO3有氧化性,H2C2O4有还原性,在酸性条件下KClO3可以和草酸(H2C2O4)生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。则根据电子守恒及原子守恒,可得该反应的化学方程式是:2KClO3+ H2C2O4+ 2H2SO4= 2ClO2+2CO2+2KHSO4+2H2O。
(5)NaClO、Na2SO3都是强碱弱酸盐,弱酸根离子发生水解反应,消耗水电离产生的H+,破坏了水的电离平衡,当最终达到平衡时,溶液中c(OH-)>c(H+),所以溶液显碱性。形成盐的酸越弱,盐水解程度就越大。消耗的离子浓度越大,当溶液达到平衡时,剩余的离子浓度就越小。由于H2SO3的Ki2=1.02×10-7;HClO的Ki1=2.95×10-8,所以酸性:HSO3->HClO,因此溶液的pH: NaClO> Na2SO3。由于电离程度:H2SO3> H2CO3>HSO3->HCO3-,浓度均为0.1 mol/L 的Na2SO3和Na2CO3的混合溶液中,水解程度:CO32–>SO32–,所以离子浓度:SO32–>CO32–;水解产生的离子浓度:HCO3- > HSO3-。但是盐水解程度总的来说很小,主要以盐电离产生的离子存在。所以在该溶液中SO32–、CO32–、HSO3–、HCO3– 浓度从大到小的顺序为SO32–>CO32–>HCO3–>HSO3–。
名师点睛
氧化还原反应、电解原理、弱电解质的电离平衡理论、盐的水解、离子浓度大小比较是中学化学中的重要知识和理论,要掌握其反应原理、规律、方法、比较依据,再结合实际情况,进行正确的判断,得到相应的答案。
答案
(1)2Cl-+2H2OCl2↑+H2↑+2OH-。
(2)阻止OH-进入阳极室,与Cl2发生副反应:2NaOH+Cl2=NaCl+NaClO+H2O;阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸。
(3)a;d。
(4)2KClO3+ H2C2O4+ 2H2SO4= 2ClO2+2CO2+2KHSO4+2H2O。
(5)大于;SO32–>CO32–>HCO3–>HSO3–。
备案号:72387-2020
备案月报: 2020年第4号(总第240号)
中国环境科学研究院。