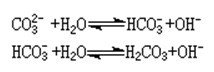碳酸
- 碳酸(英文名:carbonic acid)是一种二元弱酸,化学式为H 2CO 3,电离常数都很小。在常温、常压下,二氧化碳饱和溶液的浓度约为0.033mol/L,pH为5.6,p K a1=6.37,p K a2=10.32。
-

选择特殊符号
选择搜索类型
请输入搜索

会使紫色石蕊试液变成梅红色,碳酸显酸性,酸可使紫色石蕊变色。二氧化碳在溶液中大部分是以微弱结合的水合物形式存在,只有一小部分形成碳酸(H₂CO₃)--饱和CO₂溶液中只有1%的CO2与H2O化合成碳酸。在常温时,CO2∶H2CO3为600∶1。碳酸的热稳定性很差。碳酸加热时全部分解并放出二氧化碳。碳酸在碱的作用下,能生成酸式碳酸盐M(HCO3)2和碳酸盐MCO3〔M代表二价金属)。许多金属的酸式碳酸盐的溶解度稍大于正盐,其溶解度和Pco2(二氧化碳分压)有关。Pco2大,碳酸盐溶解于水;Pco2小(或升温),析出碳酸盐,自然界的钟乳石就是这样形成的。暂时硬水加热软化就是因为生成了碳酸盐沉淀。所有的酸式碳酸盐受热均分解为CO2和相应的正盐。 碳酸是二氧化碳气体溶于水而生成的酸。它的酸性很弱,且极为不稳定,温度稍高一些,便会分解成二氧化碳和水。碳酸和我们的日常生活有着密切的关系。我们喝的汽水就是一种碳酸饮料。
在制造汽水时,要在加压情况下把二氧化碳气体溶解在水里,再往汽水里加糖、柠檬酸以及果汁或香精,在加压下灌入汽水瓶中。当我们喝汽水时,汽水从瓶子里倒出来,外界压强(指空气压强和人体内的压强)突然降低,二氧化碳在水中的溶解度随着压强降低而变小。于是,喝入体内汽水中的二氧化碳便成为气体从水中逸出,并从口腔中排出,这个过程会把人体内的热量带走,这就是喝汽水感到凉爽的原因。
已制备出纯碳酸(碳酸晶体),但条件非常苛刻,要保存在绝对无水的条件下,不然纯碳酸会剧烈分解。

有时,碳酸也会给我们日常生活带来麻烦。地面上的二氧化碳气体溶于水,生成碳酸。当地面水渗入地下时,碳酸也被带到地下,并与地下石灰岩里不溶于水的碳酸钙发生化学反应,生成可溶于水的碳酸氢钙。含有碳酸氢钙的水称为"硬水",因此地下水都属于"硬水"。江河里的水不含碳酸氢钙,不是"硬水"(硬水是指有较多钙离子和镁离子等金属阳离子,它们的碳酸盐是不可溶解于水的)。
有些地方所用的自来水的水源是地下水,在煮开水时,水中的碳酸氢钙受热分解成碳酸钙、二氧化碳和水。碳酸钙是不溶解在水中的沉淀物,它沉积在水壶和锅炉的壁上,天长日久便成为一层白色的很坚硬的物质,称为锅垢(俗称水碱)。这层碳酸钙的导热性很差,因此烧水时会浪费燃料。如果锅炉和管道中的锅垢太厚,还有发生爆炸的危险。所以,工业生产中总是把"硬水"先用化学方法除去或减少碳酸钙,使它软化以后再用。
碳酸酸性极低,其饱和水溶液pH约为5.6,其水溶液显酸性故可以使指示剂变色(可以使石蕊溶液变红色)。
结构简式:HO—CO—OH在CO₂溶于水时形成。
纯的碳酸以C(OH)4存在是个不稳定的晶体,遇水剧烈分解。
碳酸是一种二元酸,其电离分为两步:
H₂CO₃ ⇌ HCO₃- H ; Ka1 = 4.2×10-7 mol/L; pKa1 = 6.38(25 °C)
HCO3-⇌ CO32- H ; Ka2 = 5.61×10-11 mol/L; pKa2 = 10.25 (25 °C)
需要注意的是,以上所述值并不适用于实际估算碳酸的酸性,因为单个碳酸分子的酸性比醋酸和甲酸都要强。实际上,碳酸分子只出现在二氧化碳和水的动态平衡中,其浓度比二氧化碳低得多,故酸度实际上较低。
化学反应
生成和分解
CO2溶于水生成碳酸,方程式为:CO2 H2O⇌H2CO3
碳酸不稳定、易分解,分解生成CO2和H2O,方程式为:H2CO3⇌H2O CO2↑
两种情况同时存在,达到动态平衡,方程式用“⇌”表示
复分解反应
在实验室里,二氧化碳常用稀盐酸与大理石(或石灰石,主要成分都是碳酸钙)反应来制取。反应的化学方程式可以表示如下:
CaCO3 2HCl = CaCl2 H2CO3(两种化合物互相交换成分)
碳酸不稳定容易分解成二氧化碳和水 H₂CO3⇌H2O CO2↑
总的方程式是:
CaCO₃ 2HCl=CaCl2 H2O CO2↑ (反应有气体和水生成)
酸性
碳酸是二元弱酸,会分步电离,有微腐蚀性。
H2CO3⇌HCO3- H
HCO3-⇌CO32- H
碳酸显酸性,会使紫色石蕊试液变成红色。二氧化碳在溶液中大部分是以微弱结合的水合物形式存在,只有一小部分形成碳酸(H2CO3)——饱和CO2溶液中只有1%的CO2与H2O化合成碳酸。在常温时,CO2 :H2CO3为600 :1。碳酸的热稳定性很差。碳酸加热时全部分解并放出二氧化碳。碳酸在碱的作用下,能生成酸式碳酸盐M(HCO3)2和碳酸盐MCO3(M代表二价金属)。许多金属的酸式碳酸盐的溶解度稍大于正盐,其溶解度和Pco2(二氧化碳分压)有关。Pco2大,碳酸盐溶解于水;Pco2小(或升温),析出碳酸盐,自然界的钟乳石就是这样形成的。硬水加热软化就是因为生成了碳酸盐沉淀。所有的酸式碳酸盐受热均分解为CO2和相应的正盐。
已制备出纯碳酸(碳酸晶体),但条件非常苛刻,要保存在绝对无水的条件下,不然纯碳酸会剧烈分解。

此外,橡胶用超细碳酸钙其吸收油值越高,碳酸钙对橡胶的浸润性和补强性越好,通过应用发现,在不同晶形的超细钙中,以链锁状超细碳酸钙对橡胶的补强效果最好。塑料工业是我国超细碳酸钙行业最大的用户之一,也是应用...
重质碳酸钙钙粒度是400~2500目之间的高白度精细粉末,是选用优质方解石矿石,它具有含量纯度高,白度高、粒径均匀,同时还具有无臭、无味、无腐蚀、无放射、符合环保条件等特点。由于重钙本身具有良好的分散...
我专门研究铯铷。碳酸铯和碳酸钾有相似性,也有不同点。看你做什么了。主要是看你做什么了。碳酸铯和碳酸钾是化学上说的所谓盐,但是水溶液显碱性!
有时,碳酸也会给我们日常生活带来麻烦。地面上的二氧化碳气体溶于水,生成碳酸。当地面水渗入地下时,碳酸也被带到地下,并与地下石灰岩里不溶于水的碳酸钙发生化学反应,生成可溶于水的碳酸氢钙。含有碳酸氢钙的水称为“硬水”,因此地下水都属于“硬水”。江河里的水不含碳酸氢钙,不是“硬水”。
有些地方所用的自来水的水源是地下水,在煮开水时,水中的碳酸氢钙受热分解成碳酸钙、二氧化碳和水。碳酸钙是不溶解在水中的沉淀物,它沉积在水壶和锅炉的壁上,天长日久便成为一层白色的很坚硬的物质,称为锅垢(俗称水碱)。这层碳酸钙的导热性很差,因此烧水时会浪费燃料。如果锅炉和管道中的锅垢太厚,还有发生爆炸的危险。所以,工业生产中总是把“硬水”先用化学方法除去或减少碳酸钙,使它软化以后再用。2100433B
碳酸是有机物还是无机物是科学界争执了很长时间的话题。由于同一个碳原子上连接了两个羟基,碳酸不稳定,更多显现无机物的性质,定义碳酸为无机二元弱酸,但碳酸又因含有羧基(-COOH)而能反映一些羧酸的性质。如能和醇发生酯化反应,
如:HO-COOH + H-O-C2H5 → HO-COOC2H5 + H2O
HO-COOC2H5 + H-O-C2H5 → C2H5OCOOC2H5 + H2O
因为碳酸的两个羟基都结在羰基上,故相当于二元羧酸。可以和二元醇发生酯化反应生成环酯和聚酯。
这些都是有机酸的性质。
科学家仍然对碳酸是否是有机酸争执。有科学家认为如能制得碳酸的浓溶液,那么这种碳酸具有一切二元羧酸的性质。


 碳酸钠与碳酸氢钠性质的探究教学设计
碳酸钠与碳酸氢钠性质的探究教学设计
碳酸钠与碳酸氢钠性质的探究教学设计
. . 碳酸钠与碳酸氢钠性质的探究 一、教学内容分析 《普通高中化学课程标准》 (实验)指出: “通过以化学实验为主体的多种探究活动,使 学生体验科学研究的过程, 激发学习化学的兴趣, 强化科学探究的意识, 促进学习方式的转 变,培养学生的创新精神和实践能力。 ”因此,在教学中必须强化实验的功能,改变以往的 实验只是起演示和辅助的作用, 培养学生的化学实践能力、 创新精神、 科学方法和合作精神。 本单元内容在呈现方式上有以下特点:实验较多,有利于引起学生的学习兴趣。 Na2CO3、 NaHCO 3 的性质我将采用了科学探究的形式让学生通过自主实验完成这一知识点的学习。 “让学生体验科学探究的过程, 学会科学探究的一般方法”, 并且将科学精神和人文精神自 然的融入教学当中。 充分发挥学生课堂主体地位, 又可充分发掘教师的主导作用, 这样更能 激发学生学习的兴趣和情感。 二、教学流程设计
条件特性
生成条件:氢氧化铝中存在少量碳酸铝,用易溶铝盐和碳酸盐反应,瞬间内生成碳酸铝,但瞬间又水解成氢氧化铝.
碳酸铝水解:2Al3 3CO32- 3H2O=2Al(OH)3↓ 3CO2↑
生成后的碳酸铝立即与水反应生成氢氧化铝Al(OH)3和二氧化碳CO2
这是因为生成的碳酸铝中,铝、碳、氧之间的化学键(氧键)太弱〔比氢氧化银还弱〕,所以遇水就立即水解生成氢氧化铝Al(OH)3和二氧化碳CO2。方程式Al2(CO3)3 3H2O= 2Al(OH)3↓ 3CO2↑
溶液中铝离子遇到碳酸根离子就会双水解生成氢氧化铝和二氧化碳,所以在溶液中是得不到碳酸铝的
还有碳酸铁以及碳酸铜的水解和碳酸铝相似,而碳酸镁就需加热水解。
碳酸钬是一种无机化合物,化学式为Ho2(CO3)3。
碳酸盐和酸式碳酸盐大多数为无色的。碱金属和铵的碳酸盐易溶于水,其他金属的碳酸盐都难溶于水。碳酸氢钠在水中的溶解度较小,其他酸式碳酸盐都易溶于水。碱式碳酸盐一般难溶于水。
关于碳酸盐在水中的溶解性,一般来说,碳酸盐难溶的金属,碳酸氢盐溶解度相对较大;而碳酸盐易溶的金属,碳酸氢盐的溶解度则明显减小。普遍认为是HCO3-离子在溶液中形成了氢键相互缔合,使溶解度减小的缘故。可溶性碳酸盐在水溶液中都会水解,使溶液呈碱性。如0.1Μ碳酸钠溶液的pH为11.6,其溶液中存在分步水解平衡:
其中第一步水解是主要的。对于碱金属的酸式碳酸盐来说,第二步是主要的,但水解程度远小于第一步。另外,HCO婣还要电离。因而0.1Μ碳酸氢钠水溶液呈弱碱性,pH为8.3。
难溶于水的碳酸盐都能溶于稀的强酸、乙酸或二氧化碳的饱和溶液中,例如: 碳酸盐在加热时都会分解成金属氧化物并放出二氧化碳,此反应为非氧化还原反应。(对于碳酸银,加热后由于Ag2O不稳定,即分解为单质银和氧气。)不同碳酸盐的热稳定性差异很大。其中碱金属和碱土金属碳酸盐的热稳定性较高,必须灼烧至高温才分解;而有些金属的碳酸盐的热稳性较低,加热到100℃左右就分解,如碳酸铍等;有的碳酸盐在常温下就可以分解,如碳酸汞。酸式碳酸盐的热稳定性比相同金属的碳酸盐低得多。例如碳酸钠,要851℃以上才开始分解,而碳酸氢钠在270℃左右就明显分解:
酸式碳酸盐的溶液在常温下会缓慢放出CO2而分解。