沉淀滴定法定义
以硝酸银液为滴定液,测定能与Ag 反应生成难溶性沉淀的一种容量分析法。
沉淀滴定法原理
以硝酸银液为滴定液,测定能与Ag 生成沉淀的物质,根据消耗滴定液的浓度和毫升数,可计算出被测物质的含量。
反应式:Ag X-→AgX↓
X-表示Cl-、Br-、I-、CN-、SCN-等离子。
沉淀滴定法指示终点方式
(一)铬酸钾指示剂法
1.原理
用AgNO3滴定液滴定氯化物、溴化物时采用铬酸钾作指示剂的滴定方法。滴定反应为:
终点前Ag Cl-→AgCl↓
终点时2Ag CrO42-→Ag2CrO4↓(砖红色)
根据分步沉淀的原理,溶度积(Ksp)小的先沉淀,溶度积大的后沉淀。由于AgCl的溶解度小于Ag2CrO4的溶解度,当Ag 进入浓度较大的Cl-溶液中时,AgCl将首先生成沉淀,而[Ag ]2[CrO42-]
(Ag2CrO4),Ag
2CrO
4不能形成沉淀;随着滴定的进行,Cl
-浓度不断降低,Ag
浓度不断增大,在等当点后发生突变,
[Ag
][CrO
4
2-]>Ksp(Ag
2CrO
4),于是出现砖红色沉淀,指示滴定终点的到达。
2.滴定条件
(1)终点到达的迟早与溶液中指示剂的浓度有关。为达到终点恰好与等当点一致的目的,必须控制溶液中CrO
4
2-的浓度。每50~100ml滴定溶液中加入5%(W/V)K
2CrO
4溶液1ml就可以了。
(2)用K
2CrO
4作指示剂,滴定不能在酸性溶液中进行,因指示剂K
2CrO
4是弱酸盐,在酸性溶液中CrO
4
2-依下列反应与H
离子结合,使CrO
4
2-浓度降低过多,在等当点不能形成Ag
2CrO
4沉淀。
2CrO
4
2- 2H
→←2HCrO
4
-→←Cr
2O
7
2- H
2O
也不能在碱性溶液中进行,因为Ag
将形成Ag
2O沉淀:
Ag
OH-→AgOH
2AgOH→Ag
2O↓ H
2O
因此,用铬酸钾指示剂法,滴定只能在近中性或弱碱性溶液(pH6.5~10.5)中进行。如果溶液的酸性较强可用硼砂、NaHCO
3或CaCO3中和,或改用硫酸铁铵指示剂法。
滴定不能在氨性溶液中进行,因AgCl和Ag
2CrO
4皆可生成[Ag(NH
3)
2]
而溶解。
3.主要应用
本法多用于Cl-、Br-的测定。
(二)硫酸铁铵指示剂法
1.原理
在酸性溶液中,用NH4SCN(或KSCN)为滴定液滴定Ag ,以Fe3 为指示剂的滴定方法。滴定反应为:
终点前Ag SCN-→AgSCN↓
终点时Fe3 SCN-→Fe(SCN)2 (淡棕红色)
卤化物的测定可用回滴法,需向检品溶液中先加入定量过量的AgNO3滴定液,以为Fe3 指示剂,用NH4SCN滴定液回滴剩余的AgNO3,滴定反应为:
终点前Ag (过量) X-→AgX↓
Ag (剩余量) SCN-→AgSCN↓
终点时Fe3 SCN-→Fe(SCN)2 (淡棕红色)
这里需指出,当滴定Cl-到达等当点时,溶液中同时有AgCl和AgSCN两种难溶性银盐存在,若用力振摇,将使已生成的Fe(SCN)2 络离子的红色消失。因AgSCN的溶解度小于AgCl的溶解度。当剩余的Ag 被滴定完后,SCN-就会将AgCl沉淀中的Ag 转化为AgSCN沉淀而使重新释出。
AgCl→←Ag Cl-
↓
Ag SCN-→←AgSCN
这样,在等当点之后又消耗较多的NH4SCN滴定液,造成较大的滴定误差。
2.滴定条件及注意事项
(1)为了避免上述转化反应的进行,可以采取下列措施:
a 将生成的AgCl沉淀滤出,再用NH4SCN滴定液滴定滤液,但这一方法需要过滤、洗涤等操作,手续较繁。
b 在用NH4SCN滴定液回滴之前,向待测Cl-溶液中加入1~3ml硝基苯,并强烈振摇,使硝基苯包在AgCl的表面上,减少AgCl与SCN-的接触,防止转化。此法操作简便易行。
c 利用高浓度的Fe3 作指示剂(在滴定终点时使浓度达到0.2mol/L),实验结果证明终点误差可减少到0.1%。
(2)此外,用本法时,应注意下列事项:
a 为防止Fe3 的水解,应在酸性(HNO3)溶液中进行滴定,在酸性溶液中,Al3 、Zn2 、Ba2 及CO32-等离子的存在也不干扰。与铬酸钾指示剂法相比,这是本法的最大优点。
b 为避免由于沉淀吸附Ag 过早到达终点,在用硝基苯包裹AgCl沉淀时,临近终点应轻轻旋摇,以免沉淀转化,直到溶液出现稳定的淡棕红色为止。
c 本法测定I-和Br-时,由于AgI和AgBr的溶解度都小于AgCl的溶解度,不存在沉淀转化问题,不需加入有机溶剂或滤去沉淀,滴定终点明显确切。
d 滴定不宜在较高温度下进行,否则红色络合物褪色。
(三)吸附指示剂法
1.原理
用AgNO3液为滴定液,以吸附指示剂指示终点,测定卤化物的滴定方法。
吸附指示剂是一些有机染料,它们的阴离子在溶液中很容易被带正电荷的胶态沉淀所吸附,而不被带负电荷的胶态沉淀所吸附,并且在吸附后结构变形发生颜色改变。
若以Fl-代表荧光黄指示剂的阴离子,则变化情况为:
终点前Cl-过量(AgCl)Cl-┇M
终点时Ag 过量(AgCl)Ag ┇X-
(AgCl)Ag 吸附Fl-(AgCl)Ag ┇Fl-
(黄绿色)(微红色)
2.滴定条件
为了使终点颜色变化明显,应用吸附指示剂时需要注意以下几个问题:
(1)吸附指示剂不是使溶液发生颜色变化,而是使沉淀的表面发生颜色变化。因此,应尽可能使卤化银沉淀呈胶体状态,具有较大的表面。为此,在滴定前应将溶液稀释并加入糊精、淀粉等亲水性高分子化合物以形成保护胶体。同时,应避免大量中性盐存在,因为它能使胶体凝聚。
(2)胶体颗粒对指示剂离子的吸附力,应略小于对被测离子的吸附力,否则指示剂将在等当点前变色。但对指示剂离子的吸附力也不能太小,否则等当点后也不能立即变色。滴定卤化物时,卤化银对卤化物和几种常用的吸附指示剂的吸附力的大小次序如下:
I->二甲基二碘荧光黄>Br->曙红>Cl->荧光黄
因此在测定Cl-时不能选用曙红,而应选用荧光黄为指示剂。
(3)溶液的pH应适当,常用的吸附指示剂多是有机弱酸,而起指示剂作用的是它们的阴离子。因此,溶液的pH应有利于吸附指示剂阴离子的存在。也就是说,电离常数小的吸附指示剂,溶液的pH就要偏高些;反之,电离常数大的吸附指示剂,溶液的pH就要偏低些。
(4)指示剂的离子与加入滴定剂的离子应带有相反的电荷。
(5)带有吸附指示剂的卤化银胶体对光线极敏感,遇光易分解析出金属银,在滴定过程中应避免强光照射。
沉淀滴定法测定
巴比妥类化合物,在其结构中的亚胺基受两个羰基影响,上面的H很活泼,能被Ag 置换生成可溶性银盐,而它的二银盐不溶于水,利用这一性质可进行测定。
沉淀滴定法配制与标定
(一)硝酸银滴定液
1.配制间接法配制
2.标定用基准氯化钠标定,以荧光黄指示液指示终点。
3.贮藏置玻璃塞的棕色玻瓶中,密闭保存。
(二)硫氰酸铵滴定液
1.配制间接法配制
2.标定用硝酸银滴定液标定,以硫酸铁铵指示液指示终点。
沉淀滴定法注意事项
1.用铬酸钾指示剂法,必须在近中性或弱碱性溶液(pH6.5~10.5)中进行滴定。因铬酸钾是弱酸盐,在酸性溶液中,CrO42-与H 结合,降低CrO42-浓度,在等当点时不能立即生成铬酸银沉淀;此法也不能在碱性溶液中进行,因银离子氢氧根离子生成氧化银沉淀。
2.应防止氨的存在,氨与银离子生成可溶性[Ag(NH3)2] 络合物,干扰氯化银沉淀生成。
3.硫酸铁铵指示剂法应在稀硝酸溶液中进行,因铁离子在中性或碱性介质中能形成氢氧化铁沉淀。
4.为防止沉淀转化(AgCl SCN-→←AgSCN Cl-),硫酸铁铵指示剂法加硝酸银滴定液沉淀后,应加入5ml邻苯二甲酸二丁酯或1~3ml硝基苯,并强力振摇后再加入指示液,用硫氰酸铵滴定液滴定。
5.滴定应在室温进行,温度高,红色络合物易褪色。
6.滴定时需用力振摇,避免沉淀吸附银离子,过早到达终点。但滴定接近终点时,要轻轻振摇,减少氯化银与SCN-接触,以免沉淀转化。
7.吸附指示剂法,滴定前加入糊精、淀粉,形成保护胶体,防止沉淀凝聚使吸附指示剂在沉淀的表面发生颜色变化,易于观察终点。滴定溶液的pH值应有利于吸附指示剂的电离,随指示剂不同而异。
8.吸附指示剂法选用指示剂应略小于被测离子的吸附力,吸附力大小次序为I->二甲基二碘荧光黄>Br->曙红>Cl->荧光黄。
9.滴定时避免阳光直射,因卤化银遇光易分解,使沉淀变为灰黑色。
10.有机卤化物的测定,由于有机卤化物中卤素结合方式不同,多数不能直接采用银量法,必须经过适当处理,使有机卤素转变成卤离子后再用银量法测定。
沉淀滴定法适用范围
1.铬酸钾指示剂法:在中性或弱碱性溶液中用硝酸银滴定液滴定氯化物、溴化物时采用铬酸钾指示剂的滴定方法。
2.硫酸铁铵指示剂法:在酸性溶液中,用硫氰酸铵液为滴定液滴定Ag ,采用硫酸铁铵为指示剂的滴定方法。
3.吸附指示剂法:用硝酸银液为滴定液,以吸附指示剂指示终点测定卤化物的滴定方法。
沉淀滴定法允许差
本法的相对偏差不得超过0.3%。

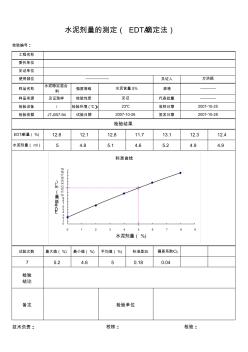 水泥EDTA滴定
水泥EDTA滴定

 沉淀分离——EDTA滴定法测定铝锰镁合金中的镁
沉淀分离——EDTA滴定法测定铝锰镁合金中的镁