


高中化学

化学姐为大家准备了有关电解质以及电离平衡的知识干货,希望大家有规律的复习!考个好成绩哦~!需要的转走!


一、电解质和非电解质
1
概念
(1)电解质:在水溶液里或熔融状态下能导电的化合物
非电解质:在水溶液里和熔融状态下都不能导电的化合物
①电解质和非电解质均指化合物,单质和混合物既不属于电解质也不属于非电解质。
②电解质必须是自身能直接电离出自由移动的离子的化合物。
③对于电解质来说,只须满足一个条件即可,而对非电解质则必须同时满足两个条件。
例如:H2SO4、NaHCO3、NH4Cl、Na2O、Na2O2、Al2O3
(2)强电解质:溶于水或熔融状态下几乎完全电离的电解质
弱电解质:溶于水或熔融状态下只有部分电离的电解质
①电解质的强弱与化学键有关,但不由化学键类型决定。强电解质含有离子键或强极性键,但含有强极性键的不一定都是强电解质,如H2O、HF等都是弱电解质。
②电解质的强弱与溶解度无关。如BaSO4、CaCO3等
③电解质的强弱与溶液的导电能力没有必然联系。
2
判断
(1)物质类别判断:
强电解质:强酸、强碱、多数盐、部分金属氧化物
弱电解质:弱酸、弱碱、少数盐和水非电解质:非金属氧化物、氢化物(酸除外)、多数有机物单质和混合物(不是电解质也不是非电解质)
(2)性质判断:
熔融导电:强电解质(离子化合物)均不导电:非电解质(必须是化合物)
(3)实验判断:
①测一定浓度溶液pH ②测对应盐溶液pH
③一定pH溶液稀释测pH变化
④同等条件下测导电性
3
电解质溶液的导电性和导电能力

①电解质不一定导电(如NaCl晶体、无水醋酸),导电物质不一定是电解质(如石墨),非电解质不导电,但不导电的物质不一定是非电解质。
②强电解质溶液导电性不一定比弱电解质强。饱和强电解质溶液导电性不一定比弱电解质强。
二、弱电解质的电离平衡
1
定义和特征
1、电离平衡的含义:
在一定条件(如温度、浓度)下,弱电解质分子电离成离子的速率与离子结合成分子的速率相等,溶液中各分子和离子的浓度都保持不变的状态叫电离平衡状态。
任何弱电解质在水溶液中都存在电离平衡,达到平衡时,弱电解质具有该条件下的最大电离程度。
2、电离平衡的特征
①逆:弱电解质的电离过程是可逆的,存在电离平衡。
②等:弱电解质电离成离子的速率和离子结合成分子的速率相等。
③动:弱电解质电离成离子和离子结合成分子的速率相等,不等于零,是动态平衡。
④定:弱电解质在溶液中达到电离平衡时,溶液里离子的浓度、分子的浓度都不再改变。
⑤变:外界条件改变时,平衡被破坏,电离平衡发生移动。
2
影响电离平衡的因素
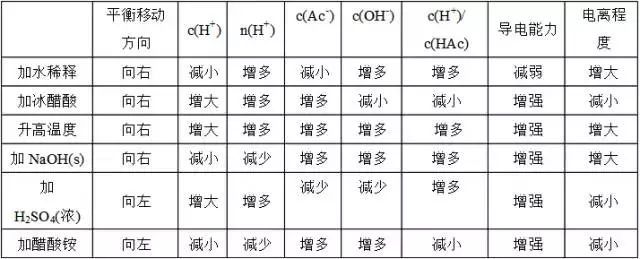
①浓度:越稀越电离在醋酸的电离平衡 CH3COOH==CH3COO-+H+加水稀释,平衡向右移动,电离程度变大,但c(CH3COOH)、c(H+)、c(CH3COO-)变小加入少量冰醋酸,平衡向右移动, c(CH3COOH)、c(H+)、c(CH3COO-)增大,但电离程度变小
②温度:T越高,电离程度越大
③同离子效应:加入与弱电解质具有相同离子的电解质时,使电离平衡向逆反应方向移动。
④加入能与弱电解质电离出的离子反应的物质时,可使平衡向电离方向移动。
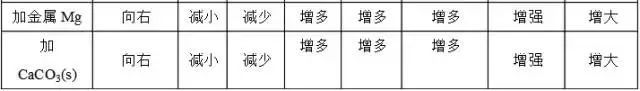
各种因素对平衡的影响可归纳为下表
3
电力方程式的书写

Tips:


 固体聚合物电解质水电解器的设计与实验
固体聚合物电解质水电解器的设计与实验











