极性溶剂
极性溶剂是指含有羟基或羰基等极性基团的溶剂,其极性强,介电常数大。极性键是共用电子对有偏移,而当偏移的非常厉害之后,看上去一边完全失电子另一边得到了电子,就会变成离子键了。
-
选择特殊符号
选择搜索类型
请输入搜索
极性溶剂是指含有羟基或羰基等极性基团的溶剂,其极性强,介电常数大。极性键是共用电子对有偏移,而当偏移的非常厉害之后,看上去一边完全失电子另一边得到了电子,就会变成离子键了。

常用溶剂的极性顺序
常用溶剂的极性顺序:水(最大)>甲酰胺>三氟乙酸>DMSO>乙腈>DMF>六甲基磷酰胺>甲醇>乙醇>乙酸>异丙醇>吡啶>四甲基乙二胺>丙酮>三乙胺>正丁醇>二氧六环>四氢呋喃>甲酸甲酯>三丁胺>甲乙酮>氯仿>乙酸乙酯>三辛胺>碳酸二甲酯>乙醚> 异丙醚>正丁醚>三氯乙烯>二苯醚>二氯甲烷>二氯乙烷>苯>甲苯>四氯化碳>二硫化碳>环己烷>己烷>煤油(石油醚)(最小)
对于溶剂的极性判断,业界还没有一个公认的标准,比较可靠的是根据溶剂介电常数做一个初步的判断。实际上应用时未必将上述溶剂全部应用(有些溶剂,例如三氟乙酸,乙酸,三乙胺,三丁胺等有着很高的反应活性,可能会与底物发生反应),往往采用混合溶剂(比如石油醚:乙酸乙酯=3:1比石油醚:乙酸乙酯=10:1的极性要大得多,可以用于柱色谱中分离)分离两种极性差不多的物质(如乙酰二茂铁和二茂铁的柱色谱分离即使用石油醚:乙酸乙酯=10:1的溶剂洗脱),同时混合溶剂也用于物质重结晶(咖啡因在75%乙醇中重结晶)。
极性键与非极性键
首先化学共价键分为极性键与非极性键。非极性键就是共用电子对没有偏移,出现在单质中比如O2;极性键就是共用电子对有偏移比如HCl。而当偏移的非常厉害之后,看上去一边完全失电子另一边得到了电子,就会变成离子键了,如NaCl 。
极性分子与非极性分子
由于极性键的出现,所以就使某些分子出现了电极性,但是并不是说所有有极性键的分子都是极性分子。比如CH4,虽然含有4个极性的C-H键,但是因为其空间上成对称的正四面体结构,所以键的极性相消,整个分子没有极性。
对于H2O,虽然与CO2有相同类型的分子式,也同样有极性共价键,但二者分子的极性却不同。CO2是空间对称的直线型,所以分子是非极性分子,H2O是折线型,不对称,所以是极性分子,作为溶剂称为极性溶剂。
化合物的极性决定于分子中所含的官能团及分子结构。各类化合物的极性按下列次序增加:
-CH3,-CH2-,-CH=,-C三,-O-R,-S-R,-NO2,-N(R)2,-OCOR,-CHO,-COR,-NH2, -OH,-COOH,-SO3H
极性,而且是强极性物质
电压互感器(PT)和电流互感器(Ct)是电力系统重要的电气设备,它承担着高、低压系统之间的隔离及高压量向低压量转换的职能。其接线的正确与否,对系统的保护、测量、监察等设备的正常工作有极其重要的意义。在...

 电流互感器(加极性、减极性)相关知识
电流互感器(加极性、减极性)相关知识
电流互感器(加极性、减极性)相关知识
极性标志有加极性和减极性,常用的电流互感器一般都是减极性,即当使一次电流自 L1 端流向 L2。时,二次电流自 K1 端流出 经外部回路到 K2。L1 和 K1, L2 和 K2 分别为同极性端。 反之,就是加极性。 低压电流互感器实用技术问答 1 .电流互感器铭牌上额定电流比的含义是什么? 答:额定电流比系指一次额定电流与二次额定电流之比。 通常用不约分的分 数表示。所谓额定电流就是在这个电流下互感器可以长期运行而不会同发热损 坏。 2 .何为电流互感器的准确等级? 答:电流互感器变换电流存在着一定的误差, 根据电流互感器在额定工作条 件下所产生的变比误差规定了准确等级。 0.l 级以上电流互感器主要用于试验, 进行精密测量或者作为标准用来校验低等级的互感器, 也可以与标准仪表配合用 来校验仪表,常被称为标准电流互感器; 0.2级和 0.5级常川来连接电气计量 仪表; 3

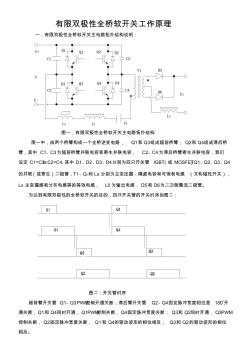 有限双极性软开关工作原理
有限双极性软开关工作原理
有限双极性软开关工作原理
有限双极性全桥软开关工作原理 一,有限双极性全桥软开关主电路拓扑结构说明: 图一,有限双极性全桥软开关主电路拓扑结构 图一中,由两个桥臂构成一个全桥逆变电路, Q1和 Q3组成超前桥臂; Q2和 Q4组成滞后桥 臂,其中 C1﹑C3为超前桥臂并联电容和寄生并联电容, C2﹑C4为滞后桥臂寄生并联电容,我们 设定 C1=C3≥C2=C4,其中 D1﹑D2﹑D3﹑D4分别为四只开关管 IGBT(或 MOSFET)Q1﹑Q2﹑Q3﹑Q4 的并联(或寄生)二极管,T1﹑CB和 Ls 分别为主变压器﹑隔直电容和可饱和电感 (又称磁性开关), Lx 主变漏感和分布电感等的等效电感, L0为输出电感, D5和 D6为二次侧整流二极管。 为达到有限双极性的全桥软开关的目的,四只开关管的开关时序如图二: 图二:开关管时序 超前臂开关管 Q1﹑Q3 PWM控制开通关断;滞后臂开关管 Q2﹑Q4固定脉冲宽度相位
质子溶剂(protic solvent)含有-OH,-NH2,如甲醇,会与亲核试剂产生氢键,使亲核试剂溶剂化。 非质子溶剂又称质子惰性溶剂,在反应体系中不能给出质子的溶剂都可以称为非质子溶剂。
非质子极性溶剂,如乙腈(CH3CN),二甲基甲酰胺(DMF),DMI,二甲基亚砜(DMSO),六甲基磷酰三胺(HMPA)等。非质子极性溶剂能使阳离子,特别是金属阳离子溶剂化。同时,也由于此类溶剂中溶剂本身不易给出质子,又有很强的溶解能力(氯化铬,氯化锌,氯化锰,氯化钾等无机盐可以溶解在乙腈,DMSO,DMF、DMI中)故在有机电化学中应用较多,尤其是DMI被称为王牌非质子极性溶剂更是应用广泛
有机化合物的溶度分组有机化合物在七种溶剂中溶解时需要依靠溶质分子与溶剂分子之间的引力,这种引力可以属于物理的、化学的或介于二者之间的,因此溶解的过程有以下几种:物理溶解 溶质与溶剂的分子之间依靠静电引力而溶解。通常,极性的溶质易溶在极性溶剂中,非极性溶质易溶在非极性溶剂中,即遵守有名的“相似相溶原则”。水是极性溶剂,乙醚是非极性溶剂,非极性的烃易溶于乙醚,不溶于水。如果在烃的分子中引入一个官能团,将使取代物的分子显出极性,因而增加在水中的溶解度。当官能团在分子中所占的比例适中时,此物在水和乙醚中都能溶解,就是S1组化合物。官能团增多,极性加强,在水中的溶解度大而在乙醚中的溶解度小。当达到不溶于乙醚的程度时,就是S2组化合物。固体在惰性溶剂中的溶解度除了决定于溶剂的本性外,与固体内部的结晶引力也有关,它的大小也决定了熔点,因此,成分和结构相似的固体物在同一种溶剂中通常以熔点低的溶解度较大。两种熔化热接近的固体也以熔点较低的具有较大的溶解度。同样,两种熔点相近的固体以熔化热小的溶解度大。各种同质异晶物中也以熔点最低的一种的溶解度最大。支链及其位置或官能团的位置对水中的溶解度影响很大,支链多而官能团又靠近分子中部时,在水中的溶解度显著增大。分子量对溶解度的影响可以表现为:①在同系物中,随着次甲基数目的增多,分子量增大,分子的性质趋向于与烃的相近,因此在水中的溶解度减小,在乙醚中的溶解度变大;②分子中代入卤原子后,卤代物的分子量增大,在水中的溶解度减小,因此S1组和S2组化合物的卤代物常不属于这两组;③有时代入卤素原子后能够改变分子的性质,这比由于分子量增大的影响要大得多,例如三氯乙酸的分子量虽然与壬酸相近,但由于氯原子的诱导效应使它在水中的溶解度很大,而壬酸却不溶于水。物理-化学溶解 溶剂对溶质的引力已经超出物理的溶解,但它们之间没有明显的化学反应,这种引力的影响通常可表现在以下的几个方面:①氢键的形成;②螯形结构的形成;③缔合作用;④盐的形成。其中以氢键最为重要。极性化合物在水中的溶解度的大小决定于分子中能够形成氢键的官能团的数目与烃基在分子中所占的比例。虽然通常极性越强的有机物在水中的溶解度越大,但有时也会被其他的因素所抵消,例如硝基苯的极性比苯酚大,但在水中的溶解度却比苯酚小,这是由于苯酚能与水形成氢键,它的影响大于极性所产生的效应。在苯酚的邻位引入羰基或硝基后,虽然增加了一个官能团,但羰基或硝基与羟基间通过氢键形成螯形结构,因而大大地削弱了与水分子形成氢键的能力,使它们在水中的溶解度减小。溶质的分子之间缔合后使有效的极性部分减少,在水中的溶解度也减小,在乙醚中的溶解度增大。醚与浓酸能形成不稳定的盐,用水稀释后又析出原来的醚;同理醛、酮和酯等中性含氧物溶解在浓硫酸或85%磷酸中时,可能也形成了盐。化学溶解 溶质与反应性溶剂起化学反应,称为化学溶解,分以下几种情况:酸性有机化合物在5%氢氧化钠溶液或5%碳酸氢钠 溶液中的溶解 酸性比碳酸强的有机化合物在这两种溶液中都能溶解,而酸性比碳酸弱的只能溶在5%氢氧化钠溶液中。磺酸、亚磺酸和某些卤代羧酸是酸性很强的有机酸,一般的羧酸是弱酸,但还能溶在5%碳酸氢钠溶液中。酚类的酸性通常很弱,属A2组,但在邻位或对位引入电负性基团后,能明显地增强酸性;当酸性超过碳酸后,就属A1组化合物。同一个碳原子上连有两个羰基的化合物,可以形成烯醇式结构,具有与酚类相近的酸性。但有的烯醇化反应很慢,因而在5%氢氧化钠溶液中溶解也非常慢,以致看不出溶解的现象。伯硝基物和仲硝基物有很显著的酸性,它们能形成酸式的互变异构物。碱性有机化合物在5%盐酸中的溶解 分子量较大的胺不溶于水,但能溶于5%盐酸中,用烃基或酰基取代氮原子上的氢原子后,通常根据取代基的电负性的大小按照以下的顺序使碱性增强:烷基<芳香基<脂肪酰基<芳香酰基<磺酰基烷基的效应与氢原子类似,因此RNH2、R2NH和R3N的碱性与NH3相近。芳香基的电负性远比脂肪基强,因此芳香胺的碱性要比脂肪胺弱得多。但苯环的邻位或对位引入电负性基团后,碱性减弱。胺的氮原子上连有两个或三个芳香基后,使碱性消失,成为中性化合物。一个脂肪酰基所产生的效应大约与三个芳香基相当,即脂肪酰胺也是中性化合物。芳香酰胺略有酸性,而芳香磺酰胺肯定已成为酸性化合物。由两个脂肪酰基或芳香酰基所形成的酰亚胺都有酸性,以二元酸衍生的酰亚胺最常见。N-取代酰胺是酸性还是中性化合物,要根据取代基的电负性才能决定。例如,乙酰-对硝基苯胺属A2组,而乙酰苯胺则是M组化合物。空间效应对酸性和碱性的影响 在酚的羟基的邻位引入取代基后,由于空间效应,能使它在5%氢氧化钠溶液中的溶度显著地减小。如果取代基很大,就不溶解。2,4,6-三叔丁苯胺也有类似的现象,它的碱性非常弱,2,6-二叔丁基吡啶的碱性比2,6-二甲基吡啶要弱得多。空间效应对羧酸也有影响,有的能降低酸性,例如2-甲基-2′-二甲基-2-乙基-4-二甲基戊酸-1的酸性大约只相当于乙酸的1/25,主要是空间效应的影响。另一方面,空间效应有时反而能增强酸性,如邻位取代苯甲酸的酸性通常比对位取代苯甲酸强,可能是取代基使羧基处于苯环的平面以外,因而羧酸的稳定性变差,倾向于离解为羧酸根离子。在取代酚中,3,5-二甲基-4-硝基苯酚的酸性比对硝基苯酚弱,可能是由于两个甲基对硝基起了空间阻碍作用。两性化合物 分子中兼有酸性和碱性基团的是两性化合物。分子量小的氨基酸极性较强,属S2组。不溶于水的两性化合物应该根据氨基的碱性强弱列入A1(B)或A2(B)组中。分子量较大的在氮原子上只连有烷基或氢原子的氨基酸属A2(B)组。此外,还有许多A2(B)组的有机物,例如不溶于水的氨基酚、氨基硫酚和氨基磺酰胺等,氨基的氮原子上取代芳基后,碱性变弱,酸性加强,例如图中a、b、c都是A1(B)组化合物。如果氨基上取代两个芳基,则碱性消失,变成A1组化合物,如图中d。
废白土中油的回收,废白土的再生
萃取温度:室温至60℃;
非极性溶剂:石油醚、溶剂油、己烷、苯、甲苯,固液比:1:2;
极性溶剂:乙醇、异丙醇,固液比1:1;
混合溶剂:非极性:极性为9:1 。
