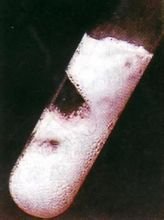
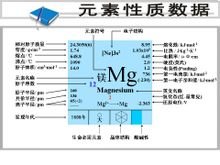
金属镁燃烧的实验
具有比较强的还原性,能与沸水反应放出氢气,燃烧时能产生眩目的白光,镁与氟化物、氢氟酸和铬酸不发生作用,也不受苛性碱侵蚀,但极易溶解于有机和无机酸中,镁能直接与氮、硫和卤素等化合,包括烃、醛、醇、酚、胺、脂和大多数油类在内的有机化学药品与镁仅仅轻微地或者根本不起作用。但和卤代烃在无水的条件下反应却较为剧烈(生成格氏试剂)镁能和二氧化碳发生燃烧反应,因此镁燃烧不能用二氧化碳灭火器灭火。镁由于能和N₂和O2反应,所以镁在空气中燃烧时,剧烈燃烧发出耀眼白光,放热,生成白色固体。在食醋中的变化为快速冒出气泡,浮在醋液面上,逐渐消失。一些烟花和照明弹里都含有镁粉,就是利用了镁在空气中燃烧能发出耀眼的白光的性质。
1.与非金属单质的反应:
2Mg+O2==点燃==2MgO
3Mg+N2==点燃==Mg3N2
Mg+Cl2==点燃==MgCl2
2.与水的反应:
Mg+2H2O==△==Mg(OH)2+H2↑
3.与酸的反应:
Mg+2HCl=MgCl2+H2 ↑ Mg+H2SO4=MgSO4+H2 ↑
4.与氧化物的反应:
2Mg+CO2==点燃==2MgO+C
*注:该反应在氧气充足时一般不发生或发生后又有 C+O2=CO2(点燃),所以在反应后不见有黑色固体生成。
5.镁与氯化铵反应:
Mg + 2NH4Cl ===MgCl2 + 2NH3↑ + H2↑
NH4+ + H2O ==(可逆)==NH3·H2O + H+(水解)
Mg+ 2H+ =====Mg2+ +H2↑ NH3H2O====NH3↑+H2O
-