三氧化二氮
三氧化二氮,氮的氧化物,一种酸性氧化物,有毒,环境污染物之一,是亚硝酸的酸酐,可溶于苯、乙醚、氯仿(三氯甲烷)、四氯化碳(四氯甲烷)、酸碱不稳定,常压下即可分解为一氧化氮和二氧化氮。三氧化二氮助燃,有毒。对环境有危害,对水体、土壤和大气可造成污染。
-
选择特殊符号
选择搜索类型
请输入搜索
三氧化二氮,氮的氧化物,一种酸性氧化物,有毒,环境污染物之一,是亚硝酸的酸酐,可溶于苯、乙醚、氯仿(三氯甲烷)、四氯化碳(四氯甲烷)、酸碱不稳定,常压下即可分解为一氧化氮和二氧化氮。三氧化二氮助燃,有毒。对环境有危害,对水体、土壤和大气可造成污染。

将等物质的量的一氧化氮和二氧化氮在低温(-21°C)混合可以得到三氧化二氮:NO+NO₂==可逆==N₂O₃
化学品英文名称:nitrogentrioxide
中文名称2:亚硝酸酐
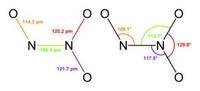
分子结构:N原子以sp2杂化轨道成键,分子为平面形分子。
英文名称2:nitrousanhydride
技术说明书编码:73
分子量:76.02
环境危害:对环境有危害,对水体、土壤和大气可造成污染。
燃爆危险:本品助燃,有毒。
有害燃烧产物:氮氧化物。
灭火方法:消防人员必须穿全身防火防毒服,在上风向灭火。切断气源。喷水冷却容器,可能的话将容器从火场移至空旷处。灭火剂:干粉、二氧化碳。
储存注意事项:储存于通风、低温的库房内。远离火种、热源。应与易(可)燃物、还原剂、食用化学品分开存放,切忌混储。储区应备有泄漏应急处理设备。
中国MAC(mg/m3):5[NO₂]
监测方法:盐酸萘乙二胺比色法
工程控制:严加密闭,提供充分的局部排风和全面通风。
呼吸系统防护:空气中浓度超标时,佩戴自吸过滤式防毒面具(半面罩)。紧急事态抢救或撤离时,建议佩戴空气呼吸器。
眼睛防护:戴化学安全防护眼镜。
身体防护:穿密闭型防毒服。
手防护:戴橡胶手套。
其他防护:工作完毕,淋浴更衣。注意个人清洁卫生。
外观与性状:红棕色气体,低温时为深蓝色液体或固体。
熔点(℃):-102
沸点(℃):-10(分解)
相对密度(水=1):1.45(0.27kPa)
相对蒸气密度(空气=1):1.45
溶解性:溶于苯、甲苯、乙醚、氯仿、四氯化碳、酸、碱。
UN编号:2421
包装类别:Z01
运输注意事项:铁路运输时须报铁路局进行试运,试运期为两年。试运结束后,写出试运报告,报铁道部正式公布运输条件。采用刚瓶运输时必须戴好钢瓶上的安全帽。钢瓶一般平放,并应将瓶口朝同一方向,不可交叉;高度不得超过车辆的防护栏板,并用三角木垫卡牢,防止滚动。严禁与易燃物或可燃物、还原剂、食用化学品等混装混运。夏季应早晚运输,防止日光曝晒。公路运输时要按规定路线行驶,禁止在居民区和人口稠密区停留。铁路运输时要禁止溜放。
两个氮原子通过σ共价键相连,在整个分子中存在着一个五中心六电子的离域大π键。氮的氧化数为+3。
2NO2==加压、或者升高温度==N2O4N2O4==减压或者降低温度===2NO2哎,我写的就是二氧化氮和四氧化二氮的转换只不过在知道上我不知道怎么写成可逆的形式,而且将条件标在可逆符号的上面和下面...
虽然是“常温常压”,但由于质量和物质的量的关系与温度、压强无关,所以46g NO2始终是1mol,46g N2O4始终是0.5mol,而1mol NO2和0.5mol N2O4都含有3mol原子,所以...
C2H8N2 + 2N2O4=点燃=2CO2↑ + 4H2O + 3N2↑用于发射人造卫星,火箭等

 三氧化二砷安全技术说明书
三氧化二砷安全技术说明书
三氧化二砷安全技术说明书
第一部分:化学品名称 化学品中文名称:三氧化二砷 化学品英文名称: arsenic trioxide 中文别名: 英文别名: 技术说明书编码: 分子式: As2O3 分子量: 197.84 第二部分:成分 /组成信息 主要成分:纯品 CAS No.: 1327-53-3 第三部分:危险性概述 危险性类别: 侵入途径: 健康危害: 主要影响神经系统和毛细血管通透性, 对皮肤和粘膜有刺激作用。急性中毒:口 服中毒出现恶心,呕吐,腹痛, “米泔”样大便,有时混有血液,四肢痛性痉挛,少尿,无 尿,昏迷、抽搐,呼吸麻痹而死亡。可在急性中毒的1~3周内发生周围神经病。可发生中 毒性心肌炎、肝炎。大量吸入亦可引起急性中毒,但消化道症状轻,指(趾)甲上出现米氏 纹。慢性中毒:消化系统症状,肝肾损害,皮肤色素沉着、角化过度或疣状增生,以及多发 性周围神经炎。可致肺癌、皮肤癌。 环境危害: 燃爆危险:
氮氧化物指的是只由氮、氧两种元素组成的化合物。常见的氮氧化物有一氧化氮(NO,无色)、二氧化氮(NO2,红棕色)、一氧化二氮(N2O)、五氧化二氮(N2O5)等,其中除五氧化二氮常态下呈固体外,其他氮氧化物常态下都呈气态。作为空气污染物的氮氧化物(NOx)常指NO和NO2。
氮氧化物(NOx)种类很多,包括一氧化二氮(N2O)、一氧化氮(NO)、二氧化氮 (NO2)、三氧化二氮(N203)、四氧化二氮(N204)和五氧化二氮(N2O5)等多种化合物, 但主要是NO和NO2,它们是常见的大气污染物。
N2O3和N2O5都是酸性氧化物,N2O3的对应酸是亚硝酸(HNO2),N2O3亚硝酸的酸酐;N2O5的对应酸是硝酸,N2O5是硝酸的酸酐。NO、N2O、N2O4和NO2都不是酸性氧化物。
天然排放的NOx,主要来自土壤和海洋中有机物的分解,属于自然界的氮循环过程。 人为活动排放的NO,大部分来自化石燃料的燃烧过程,如汽车、飞机、内燃机及工业窑炉的燃烧过程;也来自生产、使用硝酸的过程,如氮肥厂、有机中间体厂、有色及黑色金属冶炼厂等。据80年代初估计,全世界每年由于人类活动向大气排放的NOx约5300万吨。NOx对环境的损害作用极大,它既是形成酸雨的主要物质之一,也是形成大气中光化学烟雾的重要物质和消耗O3的一个重要因子。
在高温燃烧条件下,NOx主要以NO的形式存在,最初排放的NOx中NO约占95%。 但是,NO在大气中极易与空气中的氧发生反应,生成NO2,故大气中NOx普遍以NO2的形式存在。空气中的NO和NO2通过光化学反应,相互转化而达到平衡。在温度较大或有云雾存在时,NO2进一步与水分子作用形成酸雨中的第二重要酸分--硝酸(HNO3)。在有催化剂存在时,如加上合适的气象条件,N02转变成硝酸的速度加快。特别是当NO2与SO2同时存在时,可以相互催化,形成硝酸的速度更快。
此外,NOx还可以因飞行器在平流层中排放废气,逐渐积累,而使其浓度增大。NOx再与平流层内的O3发生反应生成NO与O2,N0与O3进一步反应生成NO2和O2,从而打破O3平衡,使O3浓度降低,导致O3层的耗损。
乙酯可进行硝化反应,进一步还原则生成氨基丙二酸二乙酯,它是合成氨基酸的重要中间体。生成常用的安眠药巴比妥。丙二酸二乙酯易被卤素取代,生成卤代丙二酸二乙酯;也可被三氧化二氮氧化成氧代丙二酸二乙酯。丙二酸二乙酯可以氯乙酸钠为原料,先与氰化钠作用生成氰乙酸钠,再用乙醇酯化制得。丙二 酸二 乙酯是重要的化工原料和有机合成试剂,广泛用于药物和染料的合成。