间隙式固溶体的固溶度(即非金属溶质的极限溶解度)都是很有限的,而置换式固溶体的固溶度则随合金系的不同而有很大差别------从几个ppm(mg/kg)到100%。为了预计置换式初级固溶体的固溶度,Hume-Rothery提出了以下经验规则:
(1)如果形成合金的元素的原子半径之差超过了14%~15%,则固溶度极为有限。这一规则有时称为15%规则。
(2)如果合金组元的负电性相差很大,例如当Gordy定义的负电性差值相差0.4以上时,固溶度就极小,因为此时A、B二组元易形成稳定的中间相------正常价化合物。这一规则也称负电(原子)价效应。
(3)两个给定元素的相互固溶度是与它们各自的原子价有关的,且高价元素在低价元素中的固溶度大于低价元素在高价元素中的固溶度。这一规则称为相对价效应。
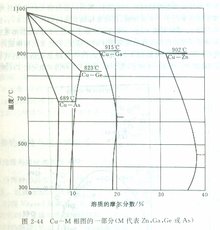
(4)如果用价电子浓度表示合金的成分,那么IIB~VB族溶质元素在IB族溶剂元素中的固溶度都相同------约为e/a=1.36,而与具体的元素种类无关。这表明在这种情形下,价电子浓度e/a是决定固溶度的一个重要因素。以Cu作溶剂为例,Zn,Ga,Ge,As等2~5价元素在Cu中的初级固溶度分别为38%,20%,12%和7.0%(见图2-44),相应的极限电子浓度分别为1.38,1.40,1.36和1.28。
(5)两组元形成无限(或连续)固溶体的必要条件是他们具有相同的晶体结构。例如前面列举的Cu-Ni,Cr-Mo,Mo-W,Ti-Zr等形成无限固溶体的合金系都符合此条件。
对于上述Hume-Rothery规则还需要作以下几点说明:
(1)在上述5条规则中,只有第1,2两条是普遍规则,其余3条都限于特定情况。例如,相对价效应仅当低价组元为Cu,Ag,Au等IB族金属时才成立;又如电子浓度虽然是影响固溶度的一个因素,但并非任意两个具有相同结构的初级固溶体的固溶度都对应着相同的电子浓度;至于第5条规则,虽然它是普遍成立的,但并不是用来确定初级固溶度的规则。由于这些原因,在不同的书中看到的Hume-Rothery规则,内容可能不尽相同。例如有的只包括1~4,1~3甚至1~2条规则。但无论如何,第1,2两条规则都是共同的,是Hume-Rothery规则的最基本内容。
(2)Hume-Rothery的第1、第2规则都是否定的规则,即它们只指出了在什么条件下不可能有显著的固溶度,而没有指出在什么条件下就肯定有显著的固溶度。
(3)上述两条规则还只是定性或半定量的规则。例如,所谓显著的固溶度并没有确切的规定。作为近似估算,人们通常认为,图
基于Hume-Rothery第1,2两条规则,Darken-Gurry提出了用作图法预计某溶质组元在给定的溶剂组元中的溶解度,这就是所谓的Darken-Gurry图。它是一个以Goldschmid原子半径为横坐标,以哥弟定义的负电性为纵坐标的图形。为了预计在给定的溶剂组元中,哪些溶质组元的固溶度可能比较大,哪些肯定很小,只需将溶剂组元和所有待分析的溶质组元的代表点按其原子半径和负电性值标在上述图中,然后以溶剂组元的代表点为中心作一椭圆,椭圆的长轴和短轴各平行于一个坐标轴,在横坐标轴方向的轴长为0.3rA,在纵坐标轴方向的轴长是0.8,这里rA是溶剂组元的Goldschmid原子半径。于是,根据溶质组元代表点相对于椭圆的位置就可以预计该组元在给定溶剂中的固溶度:若代表点在椭圆外,则固溶度必然很小,若在椭圆内则固溶度可能较大,且溶质的代表点越靠近溶剂的代表点(即椭圆中心),则固溶度可能越大。作为一个例子,图2-45分析了各种溶质组元在Ta(溶剂)中的固溶度。
利用Darken-Gurry作图方法分析大量的初级固溶体(约60种溶剂、1500种固溶体)后发现,在预计固溶度较小的固溶体中,80%~90%符合实际,即可靠性为80%~90%,而在预计固溶度较大的固溶体中只有60%符合实际,即可靠性为60%,因此在全部固溶体中用Darken-Gurry图预计固溶度的平均可靠性约为75%。
为了进一步提高预计的可靠性,Geschneider提出了进一步的修正。他首先将元素分为两类,一类是d壳层部分地被原子填充的d元素,即周期表上的IIIA-B族元素;另一类是d壳层完全未被电子填充或已完全填满的sp元素,即周期表上的IA,IIA以及IIB-VIB族元素。其次,他提出,在以下三种情形下固溶度必然很小,不必用Darken-Gurry图进行分析:
(1)溶剂和溶质二组元都是sp元素,且二者具有不同的晶体结构。
(2)溶剂为d元素,溶质为不具有常见金属结构的sp元素。
(3)溶剂为sp元素,溶质为d元素。
若仅对除以上三种情形之外的固溶体进行Darken-Gurry作图分析,则预计的可靠性将显著提高。

 有机化合物的分类习题(含答案)
有机化合物的分类习题(含答案)

 室内可吸入颗粒物中的部分有机化合物
室内可吸入颗粒物中的部分有机化合物