比较滴定文献

 水泥EDTA滴定
水泥EDTA滴定
水泥EDTA滴定
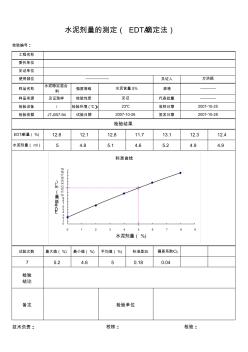
工程名称 委托单位 见证单位 使用部位 见证人 样品名称 水泥稳定混合 料 强度等级 规格 样品来源 见证取样 检验性质 代表批量 检验设备 / 检验环境 (℃) 收样日期 检验依据 JTJ057-94 试验日期 签发日期 EDTA耗量(%) 12.6 12.1 12.8 11.7 13.1 12.3 12.4 水泥剂量( ml) 5 4.8 5.1 4.6 5.2 4.9 4.9 试验次数 最大值(%) 最小值(%) 平均值(%) 标准差S 偏差系数CV 7 5.2 4.6 5 0.18 0.04 技术负责: —————— 万洪顺 水泥含量 5% ———— 水泥剂量的测定( EDTA滴定法) 检验编号: 见证 23℃ 2007-10-26 检验结果 ———— 2007-10-28 2007-10-25 检验 结论 校核: 检验: 备注 检验单位 0 1 2 3 4

 水泥剂量滴定
水泥剂量滴定
水泥剂量滴定
水泥或石灰稳定土中水泥或石灰剂量的测定方法 (EDTA滴定 法) 本方法适用于在工地快速测定水泥和石灰稳定土中水泥和 石灰的剂量,并可用以检查拌和的均匀性。用于稳定的土可 以是细粒土,也可以是中粒土和粗粒土。 本方法也可以用来测定水泥和石灰综合稳定土中结合料的 剂量。 1、仪器设备: (1)滴定管(酸式) 50mL,1支。 (2)滴定台, 1个。 (3)滴定管夹, 1 个。 (4)大肚移液管: 10mL,10 支。 (5)锥形瓶(即三角瓶): 200mL,20个。 (6)烧杯: 2000mL(或 1000mL) ,1 只; 300mL,10只。 (7)容量瓶: 1000mL,1个。 (8)搪瓷杯:容量大于 1200mL,10 只。 (9)不锈钢棒(或粗玻璃棒), 10根。 (10)量筒 :100mL 和 5mL,各一只; 50mL,2只。 (11)棕色广口瓶: 60mL,1 只(装钙红)。