选择特殊符号
选择搜索类型
请输入搜索

1833年,法拉第在研究电解作用时,从实验结果中归纳出一条规律:电流通过电解质溶液时,电极上发生化学反应的物质的量与通过溶液的电量成正比.后来人们称之为法拉第定律.
根据电化学原理,很容易得到在电极上发生反应的物质的量与通过溶液的电量之间 的关系式.
设电极反应计量方程式可表示为:
0=∑νBB+νee- (7.2-1)
式中B表示电极反应中的反应物或产物的化学式(分子式或离子式等),e-表示电极反应中的电子,νB和νe分别是两者的计量系数.当B为反应物时νB取负值,当B为产物时νB取正值;对于氧化反应νe取正值,对于还原反应,νe取负值. 例如,对于氧化反应 H2O→O2+H++4e-,νe=4;对于还原反应Cr2O72-+14H++6e-→2Cr3++7H2O,νe=-6.
当电极反应的反应进度为ξ时,通过电极的元电荷的物质的量为
ne=|νe|ξ (7.2-2)
1 mol 电子所带电量的绝对值是个常数,称为法拉第常数,用符号F表示,定义为阿佛加德罗常数L与元电荷e-的乘积,即
F=Le=6.0221367×1023mol-1×1.60217733×10-19C=96485.309Cmol-1
在一般计算中可以近似取F=96500Cmol-1.显然通过溶液的电量Q与ne的关系为:
Q=neF=|νe|ξF (7.2-3a)
在应用时常用z代替|νB|,并称之为反应的电荷数(即转移电子数),这时
Q=zξF (7.2-3b)
所以,在电极上发生反应的物质的量和质量分别为:
(7.2-4)
(7.2-5)
式(7.2-3)和式(7.2-5)均可称为法拉第定律的数学表达式.
法拉第定律是一个从电解过程中总结出来的准确定律,但它对原电池也同样适用.该定律不受温度,压力,电解质溶液的组成和浓度,电极的材料和形状等任何因素的影响,在水溶液中,非水溶液中或熔融盐中均可使用.
必须注意,在实际电解时,得到的所需产物的量往往比根据电量消耗按法拉第定律计算出来的量要少.为了便于说明这个问题,提出了电流效率的概念,定义如下:
电流效率=(根据法拉第定律计算所需要的电量/实际消耗的电量)×100%
或
电流效率=(实际获得所需产物质量/根据法拉第定律计算应得所需产物质量)×100%
实际电解过程的电流效率一般都小于100%.如工业上电解精炼铜时,电流效率通常在95~97%之间,电解制铝的电流效率约90%.引起电流效率小于100%的原因一般有以下两种:(1)电极上有副反应发生,消耗了部分电量.例如镀锌时,阴极上除了有Zn2+发生还原的主反应外,还有H+发生还原的副反应.(2)所需要的产物因一部分发生次级反应(如分解,氧化,与电极物质或溶液中的物质反应等)而被消耗.例如,电解食盐水溶液时,阳极上产生的Cl2又部分溶解在电解液中,形成次氯酸盐和氯酸盐.
根据法拉第定律,用电极上发生反应的物质的量可以精确计算出通过电路的电量.利用这个原理设计的测量电量的装置称为电量计或库仑计.这种仪器是由电解质溶液和置于其中的两个电极所构成.使用时,将其串联到电路中,通电一段时间后,称量电极上产生的物质的量,用法拉第定律求出所通过的电量.显然在电量计中所选用的电极反应的电流效率应为100%或者是十分接近100%.最常用的是银电量计,其次是铜电量计,气体电量计等.

电解质溶液的导电过程
能导电的物体称为导体.导体分为两类:一类是电子导体,如金属,石墨,某些金属氧化物(如PbO2,Fe3O4),金属碳化物(如WC)等,它们是靠自由电子在电场作用下的定向移动而导电的.当电流通过这类导体时,除了可能产生热量外,不发生任何化学变化.电子导体(例如金属导线)能够独立地完成导电任务;另一类是离子导体,如熔融的电解质,固体电解质和以水或其它有机物为溶剂而形成的电解质溶液,它们是靠离子在电场作用下的定向移动而导电的.离子导体(例如CuSO4 溶液)不能独立完成导电任务,欲使离子导体导电,必须有电子导体与之相连接.例如,为了使电流在电解质溶液中通过,需要在溶液的两端分别插入金属导体,才能构成通路,于是就形成了金属-溶液-金属串联的系统(构成这种系统的装置就是电化学装置),其中的金属就是两个电极.当电流通过离子导体时,除了可能产生热量外,在两个电极与溶液的接触面上必然伴随有化学反应发生和化学能与电能间的相互转化.
下面分别讨论在电池和电解池中电解质溶液的导电过程.
图7-3(a)为一电解池,当插在HCl水溶液中的Pt片A和B,分别用导线与外电源的负极和正极接通后,在电源电场力的作用下,电源负极的电子通过导线迁移到铂电极A上,同时铂电极B上的电子通过导线迁移到电源正极.要想维持金属导体电子的流动,铂电极A必须不断地失去电子,铂电极B必须不断地得到电子.由于电子不能从电极A直接进入溶液到达电极B,因此在电极A和溶液的界面处就发生了消耗电子的还原反应过程
2H++2e-=H2
在电极B和溶液的界面处就发生了产生电子的氧化反应过程
2Cl-=Cl2+2e-
同时,由于铂电极A,B上分别带有负电荷和正电荷,使两电极间的溶液中存在有电场,所以两电极间电解质溶液中的H+,Cl-就会在电场力作用下定向移动,从而形成了溶液中的电流.
图7-1(b)为一原电池.当H2 和Cl2分别冲击插在HCl水溶液中的Pt电极 A,B时,在电极A 与溶液界面处,H2发生氧化反应
H2→2H++2e-
电子留在电极A上,使该电极带上负电,H+进入溶液,使电极A附近的溶液带上正电.同样在电极B与溶液的界面处,Cl2发生还原反应
Cl2+2e-→2Cl-
电极B失去电子,带上正电,Cl-进入溶液,使电极B附近的溶液带上负电.这样,当两电极上的反应分别达到平衡时,两电极间就有一定的电势差.当外电路断开时,两电极上所带电荷产生的电场(电场强度的方向由A指向B)与两电极附近溶液所带电荷产生的电场(电场强度的方向由B指向A)大小相等,方向相反.所以,在溶液内部,电场强度处处为零,电势处处相等,因此离子不产生电迁移,没有电流通过.当外电路接通时,电极B上的电子在电场的作用下,通过导线流向电极A,也就是形成了自电极A流向电极B的电流,从而使两电极上的电荷减少,破坏了原来的平衡,导致了下面两种现象的同时发生:一是电极与溶液之间的电场变弱,于是,H2和Cl2又在化学力作用下进行反应,来补充两电极减少的电荷;二是两电极上的电荷在两极间溶液中产生的电场变弱,小于了两电极附近溶液中的电荷在两电极间溶液中产生的电场,因此在溶液中的电场强度不再处处为零,电势不再处处相等,而是电极A附近的溶液中的电势高于电极B附近溶液中的电势,于是溶液中的H+,Cl- 在电场的作用下,分别向电极B和A迁移,形成了溶液中的电流.
可见电解质溶液的导电过程,必须既有电解质溶液中离子的定向迁移过程,又有电极上物质发生化学反应的过程,两者缺一不可,否则就不可能形成持续的电流.
为了讨论问题的方便,习惯上把电化学装置中的两个电极按下列两种方法命名:(1)发生氧化反应的电极叫阳极,发生还原反应的电极叫阴极;(2)电势较高的电极称为正极,电势较低的电极称为负极 .在讨论电解池时常使用第(1)种命名法,在讨论原电池时常使用第(2)种命名法.但有时不论对电解池还是原电池,两种命名法都用,此时要注意两者的对应关系.
影响导电性的主要因素有电离度、电导、离子淌度、离子迁移数、离子活度和离子强度。
达到电离平衡时,已电离的电解质分子数与其总分子数之比,以百分数表示。电离度大,表示离解生成的离子多,导电能力强。在一定温度下,电解质的电离度随其浓度的减小而增大。电离度、浓度和电离常数之间的定量关系由奥斯特华冲淡定律确定。实验表明,电离度很小的弱电解质,能很好地服从冲淡定律,强电解质则基本上不服从冲淡定律,因为强电解质实际上是几乎完全电离的。溶液中不存在电力平衡问题。由于强电解质溶液中(除非无限稀释溶液)中存在强烈的离子相互作用,强电解质电离度并不反映其电离的真实情况。因而,称强电解质的电离度为表观电离度。
电阻的倒数,与电工学上电导的一般含义一致。电解质溶液的电导有两种表示方法:比电导和当量电导。比电导是指1平方厘米电极面积、电极距离1厘米的电解液的电导。当两点到是指相距1厘米的二平行电极间含有1克当量电解质的溶液的电导。
二电极间电位梯度为1V/cm时离子的移动速度,又称离子绝对移动速度。离子淌度随溶液浓度增大而减小,随温度升高而增大。电解质的离子淌度越大,其当量电导也越大。
某种离子迁移所输送的电量,占通过溶液总电量的分数,又称离子输电分数。两种淌度差别很大的离子,其迁移数相差也很大。工业电解中,可根据淌度大小,判断该种离子传导电量多少和电极附近浓度变化情况,作为控制电解条件的根据。
修正后的离子浓度,又叫有效浓度,等于离子的实际浓度与活度系数的乘积。活度系数则等于活度与浓度之比。处理极稀溶液 之外,由于溶液中离子之间及与熔剂分子之间存在着复杂的相互作用,使得离子的浓度不等同于活度,即活度系数不等于1。引进离子活度概念,即以离子活度代替离子浓度,就可以使只适用于理想溶液的一些热力学公式也能用于实际溶液中。
溶液中所有各种离子的浓度乘其价数平方之总和的一半。离子平均活度系数随离子强度增大而减小,而且离子的价数越高,减小就越多。离子强度在一定程度上反映了离子间相互作用的强弱。
法拉第笼(Faraday Cage)是一个由金属或者良导体形成的笼子。是以电磁学的奠基人、英国物理学家迈克尔·法拉第的姓氏命名的一种用于演示等电势、静电和高压带电作业原理的设备。它是由笼体、高压电源、...
【不锈钢电解抛光液是一种电解质】电解液的主要作用是:作为导电介质传递电流;在电场作用下进行电化学反应,使阳极溶解能顺利而有控制地进行;及时地把加工间隙内产生的电解产物及热量带走,起更新与冷却作用。 ...
据我所知,西安有一家法拉第橱柜卖得比较好的,位于西安市雁塔区含光路南段南大明宫建材家居城 附近公交站:东仪路站-210路; 在东仪路站下车,沿电子二路直行112米,右转直行23...
电解质溶液是指溶质溶解于溶剂后完全或部分解离为离子的溶液.相应溶质即为电解质.某物质是否为电解质并不是绝对的.同一物质在不同的溶剂中,可以表现出完全不同的性质.例如HCl在水中是电解质,但在苯中则为非电解质;葡萄糖在水中是非电解质,而在液态HF中却是电解质.因此在谈到电解质时决不能离开溶剂.一般把完全解离的电解质称为强电解质,部分解离的电解质称为弱电解质.这种分类方法只是为了讨论问题的方便,并没有反映出电解质的本质.原因是电解质的强弱随环境而变.例如乙酸在水中为弱电解质,而在液氨中则为强电解质.LiCl和KI都是离子晶体,在水中为强电解质,而在醋酸或丙酮中都变成了弱电解质.在电化学中应用最广泛的电解质溶液是电解质水溶液,本节主要讨论电解质水溶液的基本特性.
电解质溶液中的离子之间,除了具有像中性分子之间的那种相互作用之外,根据库仑定律,还存在着静电相互作用,即同性离子相互排斥,异性离子相互吸引.由分子运动论,两个中性分子之间的相互吸引力近似地与两粒子间距离的7次方成反比,而两个异性离子之间的静电吸引力却与两离子间距离的2次方成反比.这说明中性分子间的力为短程力,而带电离子间的静电引力为长程力.当电解质溶液较稀时,离子之间的距离较远,各种近程力的作用可以略去不计,而长程力却不可忽略.正是由于异性离子之间长程静电引力的存在,使得电解质溶液即使在很稀时仍表现出对理想溶液的热力学性质有较大的偏差.离子的静电相互作用的强弱除与离子间的距离(溶液的浓度)有关外,还与溶剂的介电常数,离子的结构,大小,电荷,溶剂化程度等因素有关.
正负离子之间的库仑引力,有可能使它们产生缔合作用.当电荷相反的离子接近到一定距离时,若它们之间的静电吸引势能会远远大于热运动动能,则在溶液中形成离子缔合体,这种离子缔合体可以是由两个电荷相同的异性离子组成的离子对,也可以是由三个离子或更多个离子缔合而成的离子簇团.由于离子在溶液中不停地运动,一些离子缔合体存在的时间可能是短暂的.在溶液中每一个瞬间都有许多离子缔合,同时又有许多缔合体分解.从统计的观点来看,溶液中总是有一定数量的离子缔合体存在.缔合体是靠库仑力形成,它和靠化学键形成的分子是不同的.显然电荷数大的离子在相对介电常数小的溶剂中,离子间库仑引力较大,因而离子缔合的可能性也就大些.由于缔合体作为一个整体在溶液中存在和运动,所以,在一定浓度的电解质溶液中,并非每个离子都能独立运动.对于强电解质而言,在溶液中虽然完全离子化,但并非完全解离.离子的这种缔合作用显然会影响与离子数量有关的电解质溶液的性质.
在电解质水溶液中,除了离子之间的相互作用外,离子和水分子之间也会发生相互作用,这种作用称为离子的水化作用,如果是泛指一般的溶剂,则称为溶剂化作用.如图7-1所示,离子发生水化作用时,一些极性水分子在离子周围取向,与离子紧密结合,形成水化离子.水分子被束缚在离子周围的溶剂化层内,不能独立移动,只能与离子一起移动,使游离的水分子数量减少,相当于离子实际浓度增大.当溶液很稀 时,由于水分子数量远远大于离子数,几乎所有水分子都是自由的,故水化作用对浓度的影响较小.但随着浓度的增大,自由水分子所占比率越来越少,其影响也越来越大.
离子与水分子间的作用力在两者之间的距离超过几纳米时,已可忽略不计,因此离子周围存在着一个对水分子有明显电场作用的空间.在这个空间内含有的水分子数称为离子水化数.紧靠着离子的第一层水分子与离子结合得比较牢固.它们基本上能与离子一起移动,不受温度的影响,这部分水化作用称为原水化或化学水化.它所包含的水分子数目称为原水化数.第一层以外的部分水分子也受到离子的吸引作用,使这部分水分子之间原有的结构状态发生改变.与离子的联系比较松散的这部分水化作用,叫做二级水化或物理水化.温度对它的影响很大,这部分水分子不与离子一起移动.测定原水化数的方法有多种,但所得结果很不一致.例如,Na+的水化数可由2到7.这是因为各种方法测出的水化数,实际上都是原水化数加上部分二级水化数,而每种方法中所包括进去的多少又各有不同.不过,在充分考虑了离子与水分子的各种相互作用能之后,可以通过统计力学方法,比较可靠地计算出离子水化数.实际上,离子水化数只代表与离子相结合的水分子的有效数目.离子水化的一般规律是:离子半径越小,或所带的电荷越大,则离子表面的静电势能就越高,离子的水化作用也就越强,水化数也就越大.
电解质溶液中的离子,在没有外力作用时,时刻都在进行着杂乱无章的热运动.在一定时间间隔内,粒子在各方向上的总位移为零.但是在外力作用下,离子沿着某一方向移动的距离将比其它方向大些,遂产生了一定的净位移.如果离子是在外电场力作用下发生的定向移动,我们称为电迁移.离子的电迁移不但是物质的迁移,而且也是电荷的迁移,所以离子的电迁移可以在溶液中形成电流.由于正负离子沿着相反的方向迁移,所以它们的导电效果是相同的,也就是说正负离子沿着同一方向导电.
离子的电迁移速率除了与离子的本性(离子半径,所带电荷),溶液的浓度,粘度及温度等有关外,还与电场的电势梯度有关.在其它条件一定时,离子电迁移的速率v与电势梯度成正比,即
v=U (7.1-1)
式中U为比例系数,称为离子的电迁移率,其物理意义是离子在单位电势梯度下的电迁移速率,单位是m2.V-1.s-1.离子的电迁移率是表征离子在电场中迁移的基本参数,是离子的特性.表7-1是一些离子在298.2K时无限稀释水溶液中的电迁移率U∞,它表示的是在离子之间无相互作用时的电迁移率.从表中可见离子电迁移率很小,数量级为10-8m2.s-1.V-1,所以电解时离子的移动通常很缓慢.当电解质溶液中的电势梯度为1000V.m-1时,离子迁移速率的数量级仅为10-5m.s-1,这比室温下离子热运动的速率100m.s-1要小得多.
表7-1 298.2K时无限稀释水溶液中一些离子的电迁移率
电解质溶液是指溶质溶解于溶剂后完全或部分解离为离子的溶液。溶质即为电解质。具有导电性是电解质溶液的特性,酸、碱、盐溶液均为电解质溶液。电解质溶液是靠电解质离解出来的带正电荷的阳离子和带负电荷的阴离子,在外电场作用下定向地向对应电极移动并在其上放电而实现的。电解质导电属于离子导电,其大小随温度升高而增大。离子导电必定在电极界面发生电解作用,引起物质(相关电解质)变化。通常依靠自由电子导电的金属导体为第一类导体,而称电解质溶液和熔体为第二类导体。
化合物导电的前提:其内部存在着自由移动的阴阳离子。
离子化合物在水溶液中或熔化状态下能导电;共价化合物,某些也能在水溶液中导电。
导电的性质与溶解度无关,强电解质一般有:强酸强碱,大多数盐;弱电解质一般有:(水中只能部分电离的化合物)弱酸,弱碱。另外,水是极弱电解质。
电解质不一定能导电,而只有在溶于水或熔融状态是电离出自由移动的离子后才能导电。
能导电的不一定是电解质,判断某化合物是否是电解质,不能只凭它在水溶液中导电与否,还需要进一步考察其晶体结构和化学键的性质等因素。例如,判断硫酸钡、碳酸钙和氢氧化铁是否为电解质。硫酸钡难溶于水(20 ℃时在水中的溶解度为2.4×10-4g),溶液中离子浓度很小,其水溶液 不导电,似乎为非电解质。但溶于水的那小部分硫酸钡却几乎完全电离(20 ℃时硫酸钡饱和溶液的电离度为97.5%)。因此,硫酸钡是电解质。碳酸钙和硫酸钡具有相类似的情况,也是电解质。从结构看,对其他难溶盐,只要是离子型化合物或强极性共价型化合物,尽管难溶,也是电解质。
氢氧化铁的情况则比较复杂,Fe3+与OH-之间的化学键带有共价性质,它的溶解度比硫酸钡还要小(20 ℃时在水中的溶解度为9.8×10-5 g);而落于水的部分,其中少部分又有可能形成胶体,其余亦能电离成离子。但氢氧化铁也是电解质。
判断氧化物是否为电解质,也要作具体分析。非金属氧化物,如SO2、SO3、P2O5、CO2等,它们是共价型化合物,液态时不导电,所以不是电解质。有些氧化物在水溶液中即便能导电,但也不是电解质。因为这些氧化物与水反应生成了新的能导电的物质,溶液中导电的不是原氧化物,如SO2本身不能电离,而它和水反应,生成亚硫酸,亚硫酸为电解质。金属氧化物,如Na2O,MgO,CaO,Al2O3等是离子化合物,它们在熔化状态下能够导电,因此是电解质。
可见,电解质包括离子型或强极性共价型化合物;非电解质包括弱极性或非极性共价型化合物。电解质水溶液能够导电,是因电解质可以离解成离子。至于物质在水中能否电离,是由其结构决定的。因此,由物质结构识别电解质与非电解质是问题的本质。
另外,有些能导电的物质,如铜、铝等不是电解质。因它们并不是能导电的化合物,而是单质,不符合电解质的定义。
电解质溶液的导电机理与金属的导电机理不同。金属是依靠自由电子的定向运动而导电,因而称为电子导体,除金属外,石墨和某些金属氧化物也属于电子导体。这类导体的特点是当电流通过时,导体本身不发生任何化学变化。电解质溶液的导电则依靠离子的定向运动,故称为离子导体。但这类导体在导电的同时必然伴随着电极与溶液界面上发生的得失电子反应:一般而言,阴离子在阳极上失去电子发生氧化反应,失去的电子经外线路流向电源正极;阳离子在阴极上得到外电源负极提供的电子发生还原反应。只有这样整个电路才有电流通过。并且回路中的任一截面,无论是金属导线、电解质溶液,还是电极与溶液之间的界面,在相同时间内,必然有相同的电量通过。

1. 电导和电导率
金属的导电能力常用电阻来衡量.电阻越小,导电能力越强.电解质溶液的导电能力虽然也可以用电阻来衡量,但更习惯采用的是电导.电导即电阻的倒数.用符号G表示,
(7.4-1)
电导的SI单位是"西门子"(Siemens),简称"西",用S表示.显然,导体的电导越大,导电能力越强.
因为
所以
令 κ= (7.4-2)
则 G=κ (7.4-3)
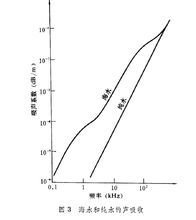
其中κ称为电导率,即电阻率的倒数.SI单位是"西每米"(Sm-1).对于电解质溶液而言,式中A表示两个相同电极中一个电极的面积,l表示两平行电极间的距离.电导率则表示面积为1m2,相距1m的两平行电极板之间包含的溶液的电导.电解质溶液的电导率与电解质的种类,溶液的浓度及温度等因素有关.图7-7是几种电解质溶液的电导率随浓度的变化曲线.可以看出:
(1)同温同浓度下强酸和强碱因能解离出H+和OH-,电导率最大,盐类次之.弱电解质因为在溶液中不完全解离,电导率最小;
(2)不管是弱电解质还是强电解质,其电导率随浓度的变化都是先增大,越过极值后又减小.这是因为浓度增大时参与导电的离子数目增多,使导电能力增强,随着浓度的增大,离子间的相互作用逐渐增强,反而又使导电能力减小减弱.弱电解质的电导率随浓度的变化不明显,是因为浓度增大时,虽然电解质分子数增加了,但解离度却随之减小,溶液中离子数目变化并不大.
了解这些情况对于生产及科学研究中合适地选用电化学装置中的电解质是有帮助的.
2.摩尔电导率
金属导体只靠电子导电,而且导体中电子浓度很高,所以只要把导体的几何形状固定了,就完全能够显示出各种导体导电能力的大小,电导率就足以反映出不同导体在导电能力上的差别.电解质溶液则不然,它们的电荷载体是离子,各种离子的电荷数可能不同,单位体积中离子的数量(浓度)也可以不一样,情况比较复杂.因此为了对不同电解质溶液的导电能力进行比较,除了应规定出它们的几何形状之外,还要对导体中离子的数量作出规定,于是提出了摩尔电导率的概念.定义如下:
把含有1mol电解质的溶液置于相距1m的两平行电极板之间时所具有的电导,叫摩尔电导率,用符号∧m表示.若电解质溶液的物质的量浓度为c(单位为molm-3),则含有1mol电解质溶液的体积Vm为1/c,单位为m3mol-1,由图7-8可以得到
∧m=Vmκ= (7.4-4)
∧m的单位为Sm2mol-1.据式(7.4-4),又可把摩尔电导率定义为单位浓度溶液的电导率.
由于摩尔电导率涉及物质的量浓度,所以在表示电解质溶液的摩尔电导率时,应注明"摩尔"的基本单元.通常用元素符号或化学式表示.如298.15K时,
∧m(CuSO4)=14.34×10-3Sm2mol-1
∧m(CuSO4)=7.17×10-3Sm2mol-1
显然,∧m(CuSO4)=2∧m(CuSO4)
在用摩尔电导率比较不同电解质溶液的导电能力时,除了要求溶液的温度和浓度相同外,应使其基本单元所带的电荷相等.例如,要比较氯化钾和硫酸铜溶液的导电能力时,应比较同温同浓度时∧m(KCl)和∧m(CuSO4)的大小.
图7-9是25℃时一些电解质在水溶液中的∧m随的变化曲线.可以看出,无论是强电解质还是弱电解质,∧m均随浓度的减少而增大,但两者的变化程度差别很大.
对于强电解质,因其在溶液中完全解离,所以在其物质的量固定为1mol的前提下,浓度的改变对离子的数量没有影响,但却影响离子之间的作用力.当浓度降低时,离子间引力减弱,离子运动速率增加,致使∧m随浓度的减小而缓慢增加.德国化学家科尔劳施(kohlrausch)由大量实验结果发现,浓度极稀(通常c<0.001moldm-3)的强电解质溶液的摩尔电导率与浓度的平方根有线性关系(见图7-9中的虚线),用式子表示为:
∧m=-A (7.4-5)
式中A在一定温度下,对给定的电解质和溶剂而言是一个常数,是直线的截距,由直线外推至与纵轴相交处得到.可见表示的是电解质溶液在无限稀释(c→0)时的摩尔电导率,故称为无限稀释摩尔电导率(又称为极限摩尔电导率).是电解质的一个特性参数,反映了电解质在离子之间没有作用力时所具有的最大导电能力.
对于弱电解质,因其在溶液中部分解离,且解离度受浓度的影响,所以当浓度降低时,虽然溶液中电解质的数量未变,仍为1mol,但解离度却增大了,离子的数量增多了,致使∧m随浓度的减少而增加.当溶液很稀时,由于解离度随浓度的减小而迅速增大,致使∧m急剧增加,∧m与c之间不存在如式(7.4-5)的简单关系.因此弱电解质的无法用外推法求得,科尔劳施的离子独立运动定律解决了这个问题.
3.离子独立运动定律和离子摩尔电导率
1875年,科尔劳施在研究极稀电解质溶液时,根据大量实验数据发现一个规律,即在无限稀释的溶液中,所有的电解质全部解离,而且离子间一切相互作用均可忽略,每一种离子都是独立运动的,不受其它共存离子的影响.因此电解质溶液的可以认为是正负离子摩尔电导率λ∞ 之和,即对于任意电解质Mν+Xν-都有下列关系式
(7.4-6)
此式称为离子独立运动定律,式中,分别表示正,负离子的无限稀释摩尔电导率.显然,如果知道了各种离子的,则无论是强电解质还是弱电解质,均可直接用此式计算.
离子的摩尔电导率可由实验测定.下表列出了298K时无限稀释的水溶液中一些常见离子的摩尔电导率.
强酸:HCl、HBr、HI、H2SO4、HNO3、HClO3、HClO4等.
强碱:NaOH、KOH、Ba(OH)2、Ca(OH)2等.
绝大多数可融性盐:如NaCl、(NH4)2SO4、Fe(NO3)3等
弱酸:HF、HClO、H2S、H2SO3、H3PO4、H2CO3等
弱碱:NH3·H2O、Fe(OH)3、Al(OH)3、Cu(OH)2等.
少数盐:HgCl2、醋酸铅等
水(极弱的电解质)

 拟静态沸点计法测定非水电解质溶液的渗透系数
拟静态沸点计法测定非水电解质溶液的渗透系数
拟静态沸点计法测定非水电解质溶液的渗透系数
The new method of Pseudo-Static Ebuiliometer for deterdring osmotic co-efficients of nonaqueous electrolyte sohitions was developed at constan temperature. Aset of eaperimental apparatus was constructed. This apparatus was ctherited with NaCl,NaBr in methanol solvent. The results are consistat with the literature values, showingthat the apparatus is reliable and the accuracy is high also. The osmotic coefficients ofsolutions of Nal, Me4NCl, Bu4NBr in methanol solvent were measured at 298.15K. Theresults are fitted by Pitzer equation. The activity coefficients of salts in methanol are cal-ctilated using Pitzer's interaction paramters obtained. The method is rapid, convenientand accurate, compared with the traditional static and isopiestic methods. It gives a pow-erful tool for measuxement of the osmotic coefficients of nonaqueous electrolyte solutions.
前者能够导电是因为电解质在水溶液中能够电离,生成阳离子和阴离子,在电场作用下它们将向相反方向移动,形成电流,产生导电现象。因此电解质溶液是一种离子导体。离子导体还包括熔盐、固体电解质、离子交换树脂膜等,所以电解质泛指有一定离子导电性的物相。物体导电能力用电导L度量,电导是电阻的倒数,单位是欧-1,也称西(门子)。物体的电导与形状有关。实验表明,电导与物体的长度l成反比,与截面积A成正比:式中κ为比例常数,称为电导率,它表示面积为1厘米2,长度为1厘米的单元体积的物体的电导,电导率的单位是欧-1·厘米-1或西/厘米。几种典型物质的电导率从上表可见,各种物质的电导率可以差很多个数量级,导电体与绝缘体只有相对含义。例如,纯水与电解质溶液相比是绝缘体,但与玻璃相比,它又具有一定的导电性,因为它能电离出少量的H 和OH-。对于电解质溶液来说,溶液的浓度对电导率有很大影响,图中表示若干典型的电解质溶液的κ与当量浓度Ceq的关系。稀溶液的电导测定可达到很高的精密度,可用来检验蒸馏水和去离子水是否合格,电导法还可测量微溶盐的溶解度、弱电解质的电离常数和海水的总盐度。电导法所得的结果是溶液的整体电导,对一般离子的分辨能力很差,只有H 和OH-是例外。利用这一特性,可进行电导滴定,以分别测量混合酸中强酸和弱酸的含量。如果电导法与色谱法联用,先通过离子交换树脂柱分离各种离子,再用电导法测量其浓度,可以获得精确度高的结果,此法称为离子色谱法。 2100433B
聚电解质溶解在水或低级醇中时,电离成为一个聚离子和许多与聚离子电荷相反的小离子,称反离子。聚离子的分子链上有许多固定的电荷,如聚酸类带负电荷,称为聚阴离子,其反离子则带正电荷,所以在聚离子的周围有静电场,使聚电解质的水溶液的性质与其他非离子结构的高分子溶液性质很不相同。
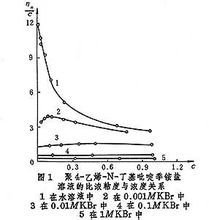
聚电解质具有高分子溶液的特性,例如粘度、渗透压和光散射等。由于它带有电荷,并且这三方面的性质又不同于一般的高分子,不能用上述溶液的特性与分子量的关系式来测算分子量。例如,聚电解质溶液的比浓粘度ηn/c与其浓度c不成线性关系。在无盐的水溶液中,比浓 粘度通常随着稀释而增加,反离子对聚离子的中和作用减弱,使链伸展,因此粘度增大。只有在适当浓度的盐溶液中才呈线性关系(图1)。所以测定聚电解质的分子量时,必须把聚电解质溶解在一定浓度的盐溶液中(见表)。用多元酸(如磷酸)中和聚阳离子(如聚乙烯吡啶)时,溶液粘度增高,有时产生沉淀。聚阳离子溶液与聚阴离子溶液混合时,立即产生聚盐而凝聚沉淀出来。聚盐只能溶解在一定浓度的LiCl、CaCl2等无机盐中, 例如,聚丙烯酸水溶液和聚乙烯吡啶丁基季铵水溶液混合时,即使溶液稀释到10N,也立即产生絮状沉淀,使溶液浑浊。 分子形态 大多数聚电解质具有柔软的分子链,可以曲折变形。这种变形大致分为四种(图2)。例如,聚合度为1000的聚丙烯酸被碱中和而完全舒展时,分子链长度为2500埃,即图2c中的l;未被中和时,则无规卷曲成半径为200埃的球形,如图2a所示。聚电解质的分子构型对生物的生命活动具有重要意义。例如,生物体中的核酸以双股螺旋形分子存在,如图2d所示,其结构构象携带生物遗传因子。又如聚L-谷氨酸-γ-苄酯,在二氯乙酸中为无规卷曲形,在其他有机溶剂中则为刚性柱状螺旋形,如图2b所示。聚电解质分子的构象对离子环境,如溶剂、温度和浓度等极敏感。

回复0402下载暑期推文:基本概念和理论拓展资料;
回复0369下载等级考一轮复习更新资料。
有一天,笔者收到这样一道题,说是大家答案不统一。
常温下,关于pH相等的盐酸和醋酸溶液(两溶液的OHˉ浓度也相等),下列说法正确的 是( B) A.c(HCl)>c(CH3COOH) B.c(Clˉ)=c(CH3COOˉ) C.等体积的盐酸和醋酸溶液分别与足量的Zn完全反应,盐酸产生的H2多 D.用相同浓度的NaOH溶液分别与等体积的盐酸和醋酸溶液恰好反应完全,盐酸消耗的NaOH溶液体积多 |
——2016年4月浙江省普通高中学业水平考试化学试题21题
类似这样的题,上海的老师和学生肯定也不会陌生,再加上下面这道题,感觉就更加完美了。
室温下对浓度、体积均相同的盐酸和醋酸溶液分别采取下列措施,有关叙述不正确的是( C) A. 醋酸溶液的pH值较大 B. 完全中和两溶液,需要浓度相同NaOH溶液的体积相等 C. 两者稀释相同倍数后,pH值变化相等 D. 加足量的锌充分反应后,两溶液中产生的氢气一样多 |
有老师曾经总结过,同浓度和同pH两种情况下强弱电解质在9个方面表现出的不同性质,是不是很~(≧▽≦)/~,可是同学们可千万不要去背(*@ο@*) 哇~,要理解,要理解!!!

图片来源:樊艳平.强弱电解质的比较与判断[J].《数理化学习(高一、二)》,2014(8)
笔者在分析这类问题的时候会牢牢抓住一条:弱电解质是有“潜力(部分电离)”的!
好比下面这张图,同体积起始状态下溶液中H+的浓度(或量)的对比。

我们简单一点,就分析一元的情况。
观上图,同浓度情况下,由于弱电解质是不完全电离的,目前状态H+实力不敌强电解质;而在pH相同情况下(即H+实力相当),同样由于弱电解质是不完全电离的,在初始状态要势均力敌,弱电解质需要比强电解质具备更多的兵力。
在一定条件下,那些潜伏的H+是可以“发光发热”的!好比下面这张图:

H+只要被“激发”是可以满格的!
笔者就是借着弱电解质是有“潜力(部分电离)”的这一条,一路过五关斩六将从题里

了出来啊,

。
可是出题的老师从来都不是按套路出牌啊,比如下面这两道题:
图片来源:通优e帮手平台

两两都是弱电解质这可怎么玩?

可是,还是有一强一弱(*@ο@*) 哇~同样可以用强弱比较模型分析处理。

如果中间来个二元酸呢?


还好,二元酸是强酸!!!注意二元酸中氢离子浓度就可以了。
在公众号内回复【0402】即可下载下列暑期“双基”推文原文和相关拓展资料的PDF版

另外,等级考一轮复习有更新哦,在公众号内回复【0369】即可下载下列试卷的PDF版

订阅用户可获赠本期内容全部word
点击下图可预订等级考一轮复习资料