缓冲溶液组成文献

 缓冲溶液的pH值与温度关系对照表资料
缓冲溶液的pH值与温度关系对照表资料
缓冲溶液的pH值与温度关系对照表资料
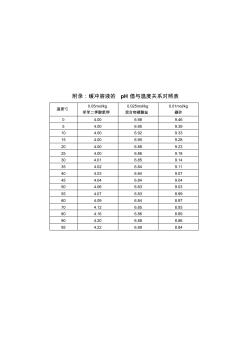
附录:缓冲溶液的 pH 值与温度关系对照表 温度℃ 0.05mol/kg 邻苯二钾酸氢钾 0.025mol/kg 混合物磷酸盐 0.01mol/kg 硼砂 0 4.00 6.98 9.46 5 4.00 6.95 9.39 10 4.00 6.92 9.33 15 4.00 6.90 9.28 20 4.00 6.88 9.23 25 4.00 6.86 9.18 30 4.01 6.85 9.14 35 4.02 6.84 9.11 40 4.03 6.84 9.07 45 4.04 6.84 9.04 50 4.06 6.83 9.03 55 4.07 6.83 8.99 60 4.09 6.84 8.97 70 4.12 6.85 8.93 80 4.16 6.86 8.89 90 4.20 6.88 8.86 95 4.22 6.89 8.84

 溶液除湿空调系列文章 溶液式空调及其应用
溶液除湿空调系列文章 溶液式空调及其应用
溶液除湿空调系列文章 溶液式空调及其应用
分析了目前空调系统面临的主要问题 ,提出了基于溶液除湿空气处理方式的解决方案。介绍了溶液除湿空气处理方式的原理和系统构成方式 ,从改善室内空气质量、改进空调末端装置方式、节省能源、改善城市能源结构等方面讨论了这一方式的优点和特点。分析表明 ,基于溶液除湿空气处理方式的湿度独立控制空调系统可有效消除空气的霉菌、粉尘 ,可以根据人员数量调节新风量 ,并通过独立的吸收或提供显热的末端装置调节温度 ,实现室内温湿度的分别控制。溶液除湿空气处理方式还可有效地对排风进行全热回收 ,并在过渡季利用干燥或低温的新风 ,从而降低空气处理能耗。由于冷水不承担除湿任务 ,因此只需要 1 8~ 2 1℃冷水用于吸收除湿过程释放的热量和室内显热。这就有可能利用各种自然冷源或采用高COP的冷水机组。溶液除湿方式还可实现高密度的能量蓄存 ,从而协调各种能源供应中的负荷匹配
