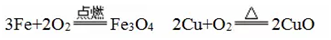金属和金属材料课程简介文献

 金属和金属材料(word)
金属和金属材料(word)
金属和金属材料(word)
金属和金属材料( word) 一、金属和金属材料选择题 1.甲、乙、丙、丁四种金属。甲即使在高温时也不与氧气反应。乙、丙、丁在一定条件下 都能与氧气反应。丁盐的水溶液可用丙制的容器盛放,但不能用乙制的容器盛放。这四种 金属的活动性由强到弱的顺序是 A.甲 >乙>丁>丙 B.丙 >丁>乙 >甲 C.丙 >乙>丁 >甲 D.乙 >丁>丙>甲 【答案】 D 【解析】 【分析】 【详解】 由甲即使在高温下也不与氧气反应知,甲最不活泼,由丁盐能与乙反应但不与丙反应知, 乙的活动性最强,丙的活动性比丁弱,综上所述,四种金属的活动性由强到弱的顺序为: 乙>丁>丙>甲;故选 D。 2.关于银的性质描述中,属于化学性质的是 ( ) A.银是银白色的 B.银不易与氧气反应 C.银具有优良的导电性 D.银具有良好的延展性 【答案】 B 【解析】 必须经化学变化才能表现的性质叫化学性质,不需要发生化学变化就能表现

 金属和金属材料知识点
金属和金属材料知识点
金属和金属材料知识点
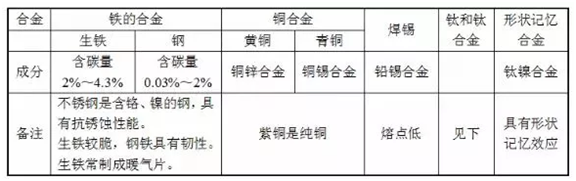
. Word 文档 九年级化学 第八单元 金属和金属材料(知识点) 第一课时 金属材料 一.金属 1.金属材料 金属材料包括纯金属和它们的合金。 ①人类从石器时代进入青铜器时代,继而进入铁器时代, 100 多年前才开始 使用铝。 ②铁、铝、铜和它们的合金是人类使用最多的金属材料,世界上年产量最多 的金属是铁,其次是铝(铝的密度小,抗腐蚀性强,在当今社会被广泛使用) 2.金属的物理性质 金属具有很多共同的物理性质:常温下金属都是固体(汞除外) ,有金属光泽, 大多数金属是电和热的优良导体,有延展性,能够弯曲,密度大,熔点高。 ① 金属除具有一些共同的物理性质外,还具有各自的特性,不同种金属的颜 色、硬度、熔点、导电性、导热性等物理性质差别较大。 ② 铁、铝、银、铂、镁等金属呈银白色,铜却呈紫红色,金呈黄色。 ③ 常温下,铁、铝、铜等大多数金属是固体,但体温计中的汞(俗称水银) 却是液体。