铍
Be原子的价电子层结构为2s,它的原子半径为89pm,Be离子半径 为31pm,Be的电负性为1.57。铍由于原子半径和离子半径特别小(不仅小于同族的其它元素,还小于碱金属元素),电负性又相对较高(不仅高于碱金属元素,也高于同族其它各元素),所以铍形成共价键的倾向比较显著,不像同族其它元素主要形成离子型化合物。因此铍常表现出不同于同族其它元素的反常性质。(1)铍由于表面易形成致密的保护膜而不与水作用,而同族其它金属镁、钙、锶、钡均易与水反应。(2)氢氧化铍是两性的,而同族其它元素的氢氧化物均是中强碱或强碱性的。(3)铍盐强烈地水解生成四面体型的离子[Be(H₂O)₂],Be-O键很强,这就削弱了O-H键,因此水合铍离子有失去质子的倾向:因此铍盐在纯水中是酸性的。而同族其它元素(镁除外)的盐均没有水解作用。
镁
中文名: 镁 符号: Mg
序号: 12
族: 2族 周期: 3
元素分区: s 原子质量: 24.305
外观: 银白色固体
熔点: 923 K(650 °C)
沸点:1363 K(1090 °C) 镁是一种轻质有延展性的银白色金属。在宇宙中含量第八,在地壳中含量第七。密度1.74克/厘米,熔点648.8℃。沸点1107℃。化合价+2,电离能7.646电子伏特,是轻金属之一,具有展性,能与热水反应放出氢气,燃烧时能产生眩目的白光,许多金属是用热还原其盐和氧化物来制备。金属镁能与大多数非金属和差不多所有的酸化合,大多数碱,以及包括烃、醛、醇、酚、胺、脂、酯和大多数油类在内的有机化学药品与镁仅仅轻微地或者根本不起作用。
钙
元素原子量40.08,银白色的轻金属。质软。密度1.54克/厘米。熔 点839±2℃。沸点1484℃。化合价+2。电离能6.113电子伏特。化学性质活泼,能与水、酸反应,有氢气产生。在空气在其表面会形成一层氧化物和氮化物薄膜,以防止继续受到腐蚀。加热时,几乎能还原所有的金属氧化物。
钙元素在自然界分布广,以化合物的形态存在,如石灰石、白垩、大理石、石膏、磷灰石等;也存在于血浆和骨骼中,并参与凝血和肌肉的收缩过程。金属钙可由电解熔融的氯化钙而制得;也可用金属在真空中还原石灰,再经蒸馏而获得。钙用来作合金的脱氧剂,以及油类的脱水剂等。
锶
元素原子量87.62,银白色软金属。密度2.6克/厘米。熔点769℃。 沸点1384℃。化合价+2。第一电离能5.695电子伏特。化学性质活泼,于空气中加热时能燃烧;易与水和酸作用而放出氢;在到熔点时即燃烧而呈红色火焰。 1808年,英国的克劳福特和戴维先后由铅矿和锶矿中发现了锶。
锶是碱土金属中丰度最小的元素。主要的矿物有天青石和碳酸锶矿。可由电解熔融的氯化锶而制得。用于制造合金、光电管,以及分析化学、烟火等。质量数90的锶是一种放射性同位素,可作β射线放射源,半衰期为25年。
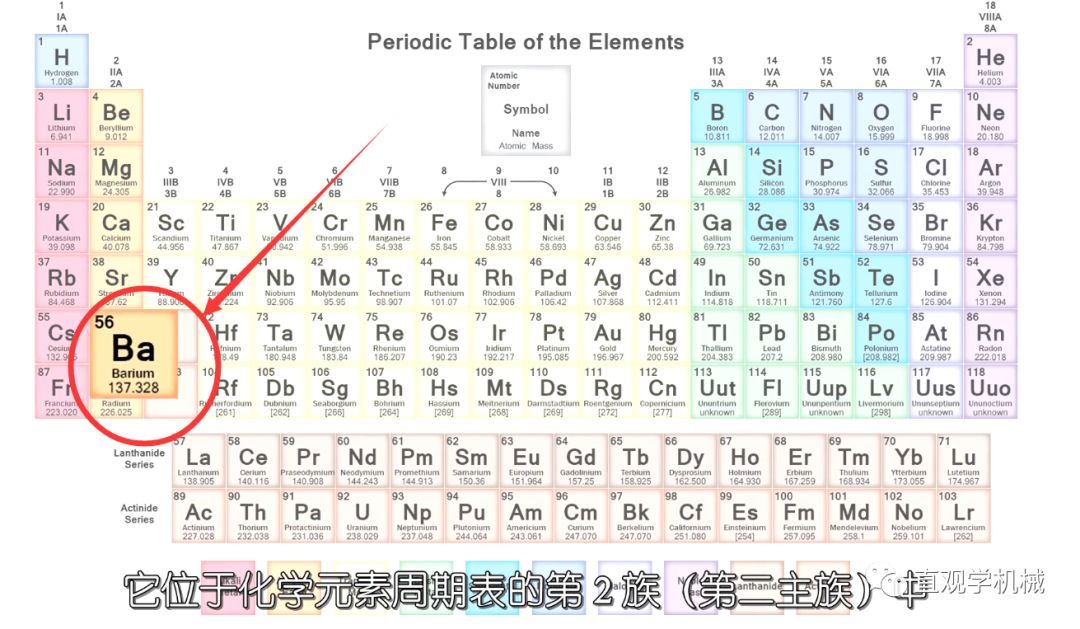
钡
元素原子量137.3,银白色金属,略具光泽,有延展性。密度3.51克 /厘米。熔点725℃。沸点1640℃。化合价+2。电离能5.212电子伏特。化学性质相当活泼,能与大多数非金属反应,在高温及氧中燃烧会生成过氧化物BaO2。易氧化,能与水作用,生成氢氧化物和氢;溶于酸,生成盐,钡盐除硫酸钡外都有毒。1808年,英国的戴维,用汞作阴极,电解由重晶石制得的电解质,蒸去汞,而制得钡。
自然界中有重晶石和碳酸钡矿。可由熔融的氯化钡在氯化铵存在下电解而制得。钡用于制钡盐、合金、焰火等;也是精制炼铜时的优良去氧剂。
镭
元素原子量:226,密度6.0克/立方厘米(20℃)。熔点700℃,沸点 约1140℃。银白色有光泽的软金属。在空气中不稳定,易与空气中氮和氧化合。与水作用放出氢气,生成氢氧化镭Ra(OH)2。溶于稀酸。化学性质与钡十分相似;所有镭盐与相应的钡盐是同晶型的。镭能生成仅微溶于水的硫酸盐、碳酸盐、铬酸盐、碘酸盐;镭的氯化物、溴化物、氢氧化物溶于水。已知镭有13种同位素,226Ra半衰期最长,为1622年。
1898年,由玛丽·居里(Marie Curie)和皮尔·居里(Pierre Curie)发现。1910年,居里夫人和德比恩电解纯的氯化镭溶液,用汞作阴极,先得镭汞齐,然后蒸馏去汞,获得金属镭。镭存在于多种矿石和矿泉中,但含量极稀少,较多的来源于沥青铀矿中。在处理沥青铀矿提取铀时,镭经常与钡一起在不溶于酸的残渣中以硫酸盐形式回收,提纯获得。镭能放射出α和γ两种射线,并生成放射性气体氡。镭放出的射线能破坏、杀死细胞和细菌。因此,常用来治疗癌症等。此外,镭盐与铍粉的混合制剂,可作中子放射源,用来探测石油资源、岩石组成等。
-