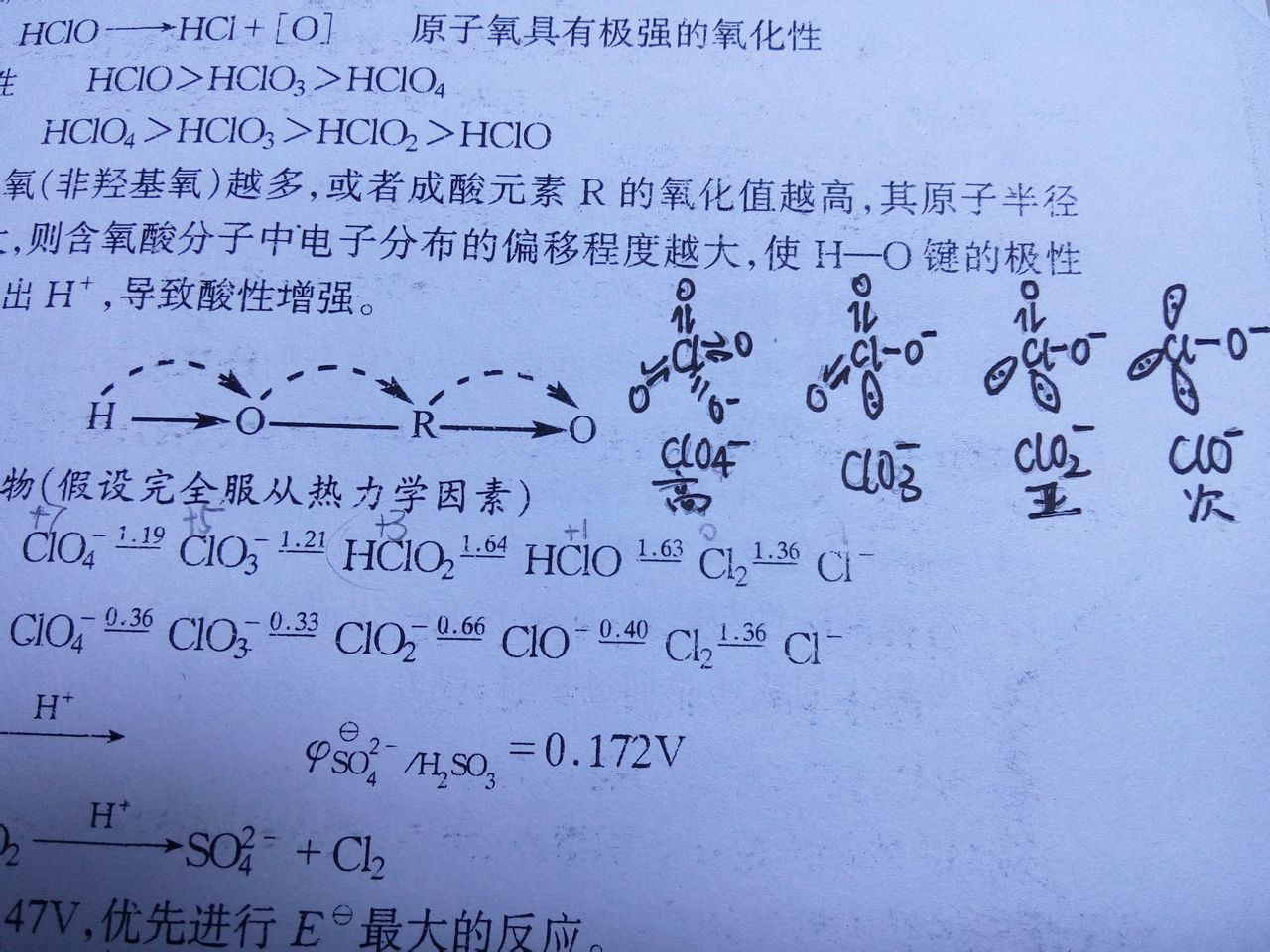
氯酸,即氯的含氧酸,其中氯的氧化态为+5.HClO3 仅存在于溶液中,是一种强酸(pKa≈−1)。水溶液在真空中可浓缩到密度1.282,即浓度40.1%。熔点<-20℃,溶解度(水)为>40g/100 ml (20 °C)加热到40℃时即分 解,并发生爆炸。浓酸浅黄色,有类似硝酸的刺激性气味。稀酸无色,在常温时没有气味。有强烈氧化性,可用于制取多种氯酸盐。由氯酸钡溶液与硫酸作用后,经过滤、蒸浓而得。热力学上,氯酸是不稳定的,会自发发生歧化反应。
-
选择特殊符号
选择搜索类型
请输入搜索
浓度在30%以下的氯酸冷溶液都是稳定的,40%的溶液也可由减压下小心蒸发制取,但氯酸浓度在超过40%时会发生分解,并剧烈爆炸,产物不一:
8HClO3=====4HClO4+2H2O+3O2↑+2Cl2↑
3HClO3 ====HClO4 + H2O + 2ClO2↑
(产生大量气体,爆炸效果与硝酸铵类似)有强烈氧化性(略弱于溴酸但强于碘酸,硫酸),常用作强氧化剂.它与金属反应一般不生成氢气,浓度较高的氯酸与铜反应会生成ClO2气体。
在普通的化学式组成中,ClO3常以原子团的形式出现,如KClO3等。
氯酸,即氯的含氧酸,其中氯的氧化态为+5.HClO3 仅存在于溶液中,是一种强酸(pKa≈−1)。水溶液在真空中可浓缩到密度1.282,即浓度40.1%。熔点<-20℃,溶解度(水)为>40g/100 ml (20 °C)加热到40℃时即分 解,并发生爆炸。浓酸浅黄色,有类似硝酸的刺激性气味。稀酸无色,在常温时没有气味。有强烈氧化性,可用于制取多种氯酸盐。由氯酸钡溶液与硫酸作用后,经过滤、蒸浓而得。热力学上,氯酸是不稳定的,会自发发生歧化反应。

1.由氯酸钡和稀硫酸反应,滤去硫酸钡沉淀后即得。
Ba(ClO3)2+H2SO4====BaSO4↓+2HClO3
2.或用次氯酸加热歧化的反应制取:
3HClO ==△==HClO3 + 2HCl
pH值:3.45(10%溶液) 1、与还原剂、有机物、易燃物如硫、磷或金属粉末等混合可形成爆炸性混合物,经摩擦、震动或撞击可引起燃烧或爆炸。2、重铵是光敏物质,曝光后能还原成三价铬。是强氧化剂,与有...
可溶于而生成锂。 急性毒性:LD50:200 mg/kg(豚鼠经口)。具刺激性。吸入、摄入或经皮吸收会中毒。大剂量可引起眩晕、虚脱。对有损害。 该品有毒,吸入或与皮肤接触时有毒害。对水是稍微危害的,若...
氟气是最活泼的非金属单质。1,与氢气在冷暗处就能剧烈反应而发生爆炸:H2+F2=2HF2,与水相遇,能够夺取水分子中的氧,生成HF并放出氧气:2F2+2H2O=4HF+O2↑3,能置换熔融氯化钠中的氯...

 乙酸乙酯的结构特点和主要化学性质
乙酸乙酯的结构特点和主要化学性质
乙酸乙酯的结构特点和主要化学性质
酯 学案 宋清冬 学习目标:乙酸乙酯的结构特点和主要化学性质。乙酸乙酯水解的基本规律。 温故知新:酯的定义。写出乙酸与乙醇反应的方程式。 学习内容: 一、酯 1、酯的一般通式: 。饱和一元羧酸和饱和一元醇形成的酯的分子式 为 ,所以这种酯与碳原子数相同的饱和一元羧酸互为同分异构体。 2、酯的通性 物理性质:酯 溶于水,易溶于 ,密度比水 ,低 级酯有果香味。这种特殊的性质往往被用来鉴别酯类化合物。 3、酯的命名:酯类化合物是根据生成酯的酸和醇的名称来命名的,例如: 4、酯的化学性质: 乙酸乙酯在 条件下完全水解; 乙酸乙酯在 条件下部分水解; 乙酸乙酯仅在加热的条件下不水解或几乎不水解。 总之在有酸(或碱)存在并加热的条件下,酯类水解生成相应的酸(或盐)和醇。 RCOOR` + H2O RCOOR` + H2O RCOOH + NaOH → 或合并为 二、酯化反应 1、一元羧酸与一元醇

 高一化学金属化学性质5
高一化学金属化学性质5
高一化学金属化学性质5
高一化学金属化学性质5
将氯化铵溶液加入到盛有氯酸钠溶液的反应器中进行反应,生成氯酸铵溶液和氯化钠结晶,过滤除去氯化钠。得到氯酸铵溶液,经精制后,用作商品出售。再经适当蒸发浓缩,冷却结晶,离心分离。制得氯酸铵。其化学方程式:
NH4Cl十NaClO3→NH4ClO3+NaCl
如何区分南京氯酸钠和次南京氯酸钠
次南京氯酸钠,化学式NaClO,是钠的次氯酸盐.次南京氯酸钠与二氧化碳反应产生的次氯酸是漂白剂的有效成分.分子式:NaClO,相对分子量:74.442(按2007年国际相对原子质量),有害物成分:次南京氯酸钠溶液 CAS No.7681-52-9.次氯酸不稳定,容易分解,放出氧气.当氯水受日光照射时,次氯酸的分解加速了.次氯酸是一种强氧化剂,能杀死水里的病菌,所以自来水常用氯气 (1L水里约通入0.002g氯气)来杀菌消毒.次氯酸能使染料和有机色质褪色,可用作漂白剂.次氯酸化学式HClO,结构式H-O-Cl,仅存在于溶液中,浓溶液呈黄色,稀溶液无色,有非常刺鼻的气味,极不稳定,是很弱的酸,比碳酸弱,和氢硫酸相当.有很强的氧化性和漂白作用,它的盐类可用做漂白剂和消毒剂,次氯酸盐中最重要的是钙盐,它是漂白粉(次氯酸钙和碱式氯化钙的混合物)的有效成分.漂白粉可由氯和消石灰反应而制得.
南京氯酸钠化学式为 NaClO3 ,相对分子质量106.44.通常为白色或微黄色等轴晶体.味咸而凉,易溶于水、微溶于乙醇.在酸性溶液中有强氧化作用,300℃ 以上分解出氧气.南京氯酸钠不稳定.与磷、硫及有机物混合受撞击时易发生燃烧和爆炸,易吸潮结块,有毒.工业上主要用于制造二氧化氯、亚南京氯酸钠、高氯酸盐及其它氯酸盐.常温下为无色立方晶体或三方结晶或白色粉末.味咸而凉.密度2.490g/cm3.熔点255℃.易溶于水,0℃在水中的溶解度为79g.溶于乙醇、甘油、丙酮、液氨.常压下加热至300℃以上易分解放出氧气.在中性或弱碱性溶液中氧化力非常低,但在酸性溶液中或有诱导氧化剂和催化剂(如硫酸铜)存在时,则是强氧化剂.与酸类(如硫酸)作用放出二氧化氯.有极强的氧化力.与硫、磷和有机物混合或受撞击,易引起燃烧和爆炸.易潮解.对皮肤和黏膜有局部刺激作用,制剂有70%粉剂和25%颗粒剂.有毒.印染工业用作染精元布的氧化剂,也可作媒染剂.无机工业用作氧化剂,也可用于制造亚南京氯酸钠及高氯酸盐.医药工业用于制造药用氧化锌、二硫基丁二酸钠.颜料工业用于制造高级氧化锌和华兰.农业上用作除草剂.此外,还用于造纸、鞣革.矿石处理、海水提溴和制造印刷油墨、炸药等.)
我国氯酸钾的生产以电化法为主,而化学法只是在平衡氯气时采用,化学法只占氯酸钾总产量的十分之一。 由两步法,即食盐水电解制得氯酸钠,而后再与氯化钾进行复分解反应,改为一步法,即由氯化钾一步电解直接制得氯酸钾,多年来国内外均在进行研究。 大连氯酸钾厂在化工部天津化工研究院和大连图书馆等单位的协助下,由1979年就开始对氯化钾直接电解制氯酸钾一步法进行了试验研究,并获得了成功。
电解NaCl:NaCl+3H2O→高温电解→3H2+NaClO3
NaClO3和KCl发生复分解反应,生成KClO3和杂质盐,降温使KClO3析出。
金属氯酸盐一般通过氯气通入热的金属氢氧化物溶液中制备,如KClO3的制备反应:
3Cl2+ 6KOH → 5KCl + KClO3 + 3H2O
工业上生产氯酸钾时,先电解氯化钠溶液生成氯酸钠,再使之与钾盐反应沉淀制得氯酸钾。
其他氯含氧酸
氯的其他常见含氧酸列在下表:
俗名 系统命名 氧化态 化学式 盐类名称
次氯酸 氯酸(I) +1 HClO 次氯酸盐
亚氯酸氯酸(III) +3 HClO2 亚氯酸盐
氯酸 氯酸(V) +5 HClO3 氯酸盐
高氯酸 氯酸(VII) +7 HClO4 高氯酸盐