水的电离2:影响水电离的因素文献

 从水电离平衡话水的电离程度
从水电离平衡话水的电离程度
从水电离平衡话水的电离程度
在溶液中,水的电离程度大小的比较,常常困扰着初学者,本文对水在酸溶液、碱溶液、强酸弱碱盐溶液及弱酸强碱盐溶液中电离程度进行了深刻的分析,并总结出水在不同环境中其电离程度的比较规律。

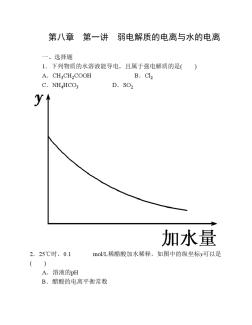 第八章第1讲弱电解质的电离与水的电离
第八章第1讲弱电解质的电离与水的电离
第八章第1讲弱电解质的电离与水的电离
第八章第1讲弱电解质的电离与水的电离






