水的电离极弱的电解质文献

 第八章第1讲弱电解质的电离与水的电离
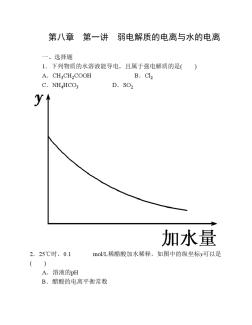
第八章第1讲弱电解质的电离与水的电离
第八章第1讲弱电解质的电离与水的电离
第八章第1讲弱电解质的电离与水的电离

 高二化学第四讲弱电解质的电离和水的电离
高二化学第四讲弱电解质的电离和水的电离
高二化学第四讲弱电解质的电离和水的电离
第四讲弱电解质的电离和水的电离 考点一:电解质,非电解质,强、弱电解质的概念 1.根据你对电解质和非电解质的理解判断下列说法是否正确。 (1)电解质在水溶液中和熔融状态下都能导电() (2)固体氯化钠不导电,所以它不是电解质() (3)铜和石墨都能导电,它们都是电解质; Cl2不能导电,故 Cl 2是非电解质() (4)醋酸钠晶体不导电,醋酸钠溶液能导电,所以醋酸钠溶液是电解质,醋酸钠晶体是非电解质() (5)把 SO3溶于水所得的溶液能导电,所以 SO3是电解质() (6)BaSO4难溶于水,所以 BaSO4是非电解质() 2.现有以下物质:① NaCl 晶体②液态 HCl③CaCO3固体④熔融 KCl⑤蔗糖⑥铜⑦ CO2⑧H 2SO4⑨KOH 固 体⑩盐酸。以上物质能导电的 ,以上物质属于电解质的是 ,属于非 电解质的是 。 3.把 0.05molNaOH 固体分别加入到 100mL






