
分子中和两个相邻共价键之间的夹角。例如H2O分子中两个H-O键的夹角为104.5°,CO2分子中两个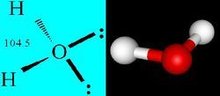 C=O键间的夹角为180°。键长和键角决定分子的空间构型。H2O和CO2同是三原子分子,但H2O分子是V形而CO2分子是直线型。NH3分子中三个 N-H键的键长相等,两个 N-H键之间的夹角为 107°18′,NH3分子呈三角锥形。又如CH4分子,四个C-H键的键长相等,C-H键之间的夹角均为109°28′,CH4分子是正四面体形。周期表中,同族非金属元素的氢化物或卤化物,组成相似,分子结构相同,例如第ⅣA族元素形成的CH4、CCl4、SiH4、SiF4等,它们的分子均是正四面体结构。又如氧族的氢化物H2O、H2S、H2Se等,它们的分子均是V形结构。还有BF3、BCl3、SO3……键角120°只能是平面三角形(正三角),就是三角形顶点各有一个原子,中心原子处于三角形的重心 ,例如正六边形的每个内角都是120度,苯的结构就是正六边形。
C=O键间的夹角为180°。键长和键角决定分子的空间构型。H2O和CO2同是三原子分子,但H2O分子是V形而CO2分子是直线型。NH3分子中三个 N-H键的键长相等,两个 N-H键之间的夹角为 107°18′,NH3分子呈三角锥形。又如CH4分子,四个C-H键的键长相等,C-H键之间的夹角均为109°28′,CH4分子是正四面体形。周期表中,同族非金属元素的氢化物或卤化物,组成相似,分子结构相同,例如第ⅣA族元素形成的CH4、CCl4、SiH4、SiF4等,它们的分子均是正四面体结构。又如氧族的氢化物H2O、H2S、H2Se等,它们的分子均是V形结构。还有BF3、BCl3、SO3……键角120°只能是平面三角形(正三角),就是三角形顶点各有一个原子,中心原子处于三角形的重心 ,例如正六边形的每个内角都是120度,苯的结构就是正六边形。
键角会受分子内的结构改变的影响,如在NH3中,键角本应为109°28′,但由于N有一个独立电子对,因此压迫N原子,使键角减小,为107°18′。
