
氮化锂属于六方晶系,晶体结构如图所示。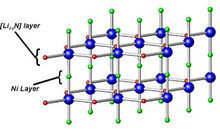
在氮化锂晶体中,存在锂、氮原子共同组成的锂、氮层。其排布方式为锂原子以石墨晶体中的碳原子方式排布,氮原子在锂原子构成的六边形的中心。在锂、氮层之间存在锂层。因为锂、氮层中锂氮比为2:1,即为Li2N,不符合化学计量式Li3N,所以在每两个锂、氮层之间还有一个锂层。
在氮化锂晶胞中,Li-N之间的距离为213pm,接近锂离子和氮负离子的离子半径之和,每个锂、氮层与相邻的锂层间距为194pm,这表明氮化锂是一种离子化合物。
熔点:845℃
熵:S = 37.6 J/(mol·K)
生成焓:ΔHf = -198.6 kJ/mol
生成自由能:ΔGf = -155.1 kJ/mol
热容:Cp = 75.2 J/(mol·K)
溶解性:不溶于多数有机溶剂。
在潮湿的空气中稳定,因表面覆盖了一层保护层。
与水反应生成氢氧化锂和氨:
Li3N (s) + 3 H2O (l) → 3 LiOH (aq) + NH3 (g)
氮化锂是超强碱,其碱性比负氢离子还要强,因此可以将氢去质子化:
Li3N (s) + H2 (g) → Li2NH (s) +LiH (s)
氮化锂在氢气中加热时可相继得到氨基锂(LiNH2)、亚氨基锂(Li2NH),最终转化为氢化锂,并放出氨。
由于氮化锂吸收氢气的反应在270℃时可逆,氮化锂可作为氢气储存的媒介,最多可吸收其重量 11.5% 的氢气。不论上述反应朝哪个方向进行,氨基锂(LiNH2)和亚氨基锂(Li2NH)总是反应的中间产物。
氮化锂的反应性能很强,特别是在高温时,能够腐蚀铁、镍、铜、铂、石英和陶瓷等。
