
危险性
EU分类 可燃(F)
第一类致癌物质
第二类致诱变剂
有毒(T)
NFPA 704
4
3
0
警示性质 R45, R46, R11, R36/38,
标准词 R48/23/24/25, R65
安全建议 S53, S45
标准词
相关化学品
相关化学品 环丁二烯、苯、环辛烷
若非注明,所有数据都依从国际单位制,以及来自标准状况(25 °C, 100 kPa)的条件。
环辛四烯稳定性不高,容易生成爆炸性的有机过氧化物,因此市售产品中通常加入少量的氢醌作稳定剂。使用环辛四烯之前应当检验过氧化物的存在。过氧化物多以白色晶体的形式附着在瓶盖和瓶颈周围,如果处理方式不当可能引发爆炸,因此使用时必须小心。环辛四烯的化学性质类似于多烯烃:它可以与过酸或二甲基过氧化酮作用生成单或多环氧化的产物,也可以与溴、卤化氢发生加成反应。烷基取代的环辛四烯发生开环复分解聚合,可以得到稳定的聚乙炔衍生物。环辛四烯可以发生电环化反应生成双环[4.2.0]辛-2,4,7-三烯,这两者形成平衡但以环辛四烯为主(99.99%),双环形式只占约0.01%。但环辛四烯溴化时,主要生成的是7,8-二溴双环[4.2.0]辛-2,4-二烯。(参考资料)在70℃和~300nm光源照射气相环辛四烯时,环辛四烯可以几乎定量地异构为半瞬烯(Semibullvalene)--三环[3.3.0.0]辛-3,6-二烯。
衍生出的负离子:
 双(环辛四烯基)铀是环辛四烯配合物的一个例子,它属于夹心型配合物,两个环辛四烯环分别位于铀原子上下。
双(环辛四烯基)铀是环辛四烯配合物的一个例子,它属于夹心型配合物,两个环辛四烯环分别位于铀原子上下。
环辛四烯(COT)与金属钾作用时生成K2COT,其中环辛四烯被还原为深棕色10π有芳香性、平面结构的COT双负离子。以K2COT为原料,可以制得一些环辛四烯可以与金属(如稀土金属)形成的配合物,比如夹心型的双(环辛四烯基)铀U(COT)2、双(环辛四烯基)铁Fe(COT)2,以及一维结构的Eu-COT。
Fe(COT)2在甲苯中与二甲基亚砜和二甲氧基乙烷回流5天后,转化为四氧化三铁(磁铁矿)和含有碳纳米管的晶状碳单质。
结构:
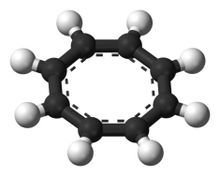
 虽然早期的电子衍射实验结果显示环辛四烯中的碳-碳键长是等同的,但一开始对环辛四烯的研究便显示出,环辛四烯没有表现出预期的芳香性。后来H.S. Kaufman的X光衍射结果也证实了环辛四烯中的碳-碳键确有两种不同的键长,C=C键键长为1.34Å,C-C键键长为1.48Å。这说明,环辛四烯虽然与苯一样是一种轮烯,但它不是芳香烃,通常状态下为非平面的澡盆型结构(D2d),键角∠C=C-C = 126.1°,∠C=C-H = 117.6°。由于不是平面结构,因此环辛四烯既没有芳香性,也没有反芳香性,也不适用于休克尔规则分析。如果将环辛四烯浴盆状构象(D2d)的能量看作0,那么理论计算得出其双键定域的平面结构(D4d)的能量为44.35kJ/mol,其双键电子离域的平面结构(D8d)的能量则为61.50kJ/mol(HF/6-31G*结果)。因此环辛四烯最稳定的构象是澡盆型。由于不为平面结构且双键定域,因此取代的环辛四烯可能有两种异构体:环反转(类似于胺的氮反转)异构体,以及双键易位的互变异构体(类似于苯的两种凯库勒式)。
虽然早期的电子衍射实验结果显示环辛四烯中的碳-碳键长是等同的,但一开始对环辛四烯的研究便显示出,环辛四烯没有表现出预期的芳香性。后来H.S. Kaufman的X光衍射结果也证实了环辛四烯中的碳-碳键确有两种不同的键长,C=C键键长为1.34Å,C-C键键长为1.48Å。这说明,环辛四烯虽然与苯一样是一种轮烯,但它不是芳香烃,通常状态下为非平面的澡盆型结构(D2d),键角∠C=C-C = 126.1°,∠C=C-H = 117.6°。由于不是平面结构,因此环辛四烯既没有芳香性,也没有反芳香性,也不适用于休克尔规则分析。如果将环辛四烯浴盆状构象(D2d)的能量看作0,那么理论计算得出其双键定域的平面结构(D4d)的能量为44.35kJ/mol,其双键电子离域的平面结构(D8d)的能量则为61.50kJ/mol(HF/6-31G*结果)。因此环辛四烯最稳定的构象是澡盆型。由于不为平面结构且双键定域,因此取代的环辛四烯可能有两种异构体:环反转(类似于胺的氮反转)异构体,以及双键易位的互变异构体(类似于苯的两种凯库勒式)。
天然存在形式:
环辛四烯已在某些真菌中分离出来。
