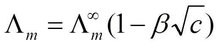电导率影响因素文献

 特定频谱波对水电导率影响的研究
特定频谱波对水电导率影响的研究
特定频谱波对水电导率影响的研究
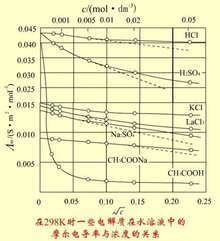
目的:为了研究特定频谱波引起的水中离子浓度的变化以及电导率与频谱波间相互作用的规律,用特定频谱波对理化特性略有不同的纯净水、自来水、海水进行影响,研究其电导率的变化。方法:采用一元线性回归分析的方法对数据散点进行拟和,用方差分析来评价其拟合效果,以期发现其中的规律。结果:经过频谱波的影响各种水的电导率都有明显的提高,并且随着处理次数的增加,纯净水的电导率呈阶越式方式增加;自来水呈对数形式增加;而海水则表现为变化幅度微小。结论:造成这个现象的原因可能是由于水分子吸收了频谱波的能量,分子的平均动能增大造成的。这一过程使化学平衡(H2O)n≒xH2O+(H2O)n-x和H2O≒ H++OH-均向分解的方向运动,水中带电离子的浓度提高,因此电导率发生变化。而电导率提高方式的差异,则是水样在理化特性上的差异导致的。

 电导率对城镇污泥电渗透脱水效果的影响
电导率对城镇污泥电渗透脱水效果的影响
电导率对城镇污泥电渗透脱水效果的影响
采用电渗透脱水技术对经机械脱水的城镇污泥泥饼进行深度脱水,考察了使用添加Na2SO4溶液以及使用去离子水清洗的方式改变污泥的电导率对污泥电渗透脱水效果与能耗的影响.结果表明,随着添加的Na2SO4的量的增加,污泥的电导率从1103μS/cm上升至2575μS/cm,电渗透脱水后污泥的最终含水率从51.2%降低至45.7%,脱水效果有所提高,但是由于初始阶段通过污泥泥饼的电流的增加,脱水过程中所需能耗也相应上升23.3%~69.2%.随着对污泥清洗次数的增加,污泥的电导率从988μS/cm上升至371μS/cm,电渗透脱水后污泥的最终含水率从52.3%增加至53.1%,脱水效果有所下降,但是由于初始阶段通过污泥泥饼的电流的降低,使得所需能耗降低15%~24%.因此,对电导率较低的污泥使用电渗透脱水技术进行深度脱水,可以在保证脱水效果的情况下最大限度地降低能耗.