化合物
化合物由两种或两种以上元素的原子(指不同元素的原子种类)组成的纯净物。是指从化学反应之中所产生的纯净物(区别于单质)。
-
选择特殊符号
选择搜索类型
请输入搜索
化合物由两种或两种以上元素的原子(指不同元素的原子种类)组成的纯净物。是指从化学反应之中所产生的纯净物(区别于单质)。

化合物(compound)主要分为有机化合物和无机化合物.
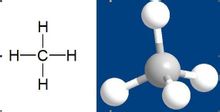
有机化合物含有碳氢化合物(或叫做烃,hydrocarbon),如甲烷(methane, CH₄) ,分为:糖类、核酸、脂质和蛋白质。
无机化合物不含碳氢化合物,如硫酸铅(lead (II) sulphate, PbSO4),分为:酸、碱、盐和氧化物
离子化合物,一般含有金属元素,例如氧化钠
共价化合物,例如水。
一 通过的TLC纯度的鉴定
1 展开溶剂的选择,不只是至少需要3种不同极性展开系统展开,我的经验是首先要选择三种分子间作用力不同的溶剂系统,如氯仿\甲醇,环己烷\乙酸乙酯,正丁醇\醋酸\水,分别展开来确定组分是否为单一斑点.这样做的好处是很明显的,通过组份间的各种差别将组分分开,有可能几个相似组份在一种溶剂系统中是单一斑点,因为该溶剂系统与这几个组分的分子间力作用无显著的差别,不足以在TLC区分.而换了分子间作用力不同的另一溶剂系统,就有可能分开.这是用3种不同极性展开系统展开所不能达到的.
2 对于一种溶剂系统正如wxw0825所言,至少需要3种不同极性展开系统展开,一种极性的展开系统将目标组分的Rf推至0.5,另两种极性的展开系统将目标组分的Rf推至0.8,0.2。其作用是检查有没有极性比目标组分更大或更小的杂质。
3 显色方法,光展开是不够的,还要用各种显色方法。一般一定要使用通用型显色剂,如10%硫酸,碘,因为每种显色剂(不论是通用型显色剂,还是专属显色剂在工作中都遇到他们都有一化合物不显色的时候),再根据组分可能含有混杂组份的情况,选用专属显色剂。只有在多个显色剂下均为单一斑点,这时才能下结论样品为薄层纯
二 通过熔程,判断纯度。原理很简单,纯化合物,熔程很短,1,2度。混合物熔点下降,熔程变长。
三,基于HPLC的纯度鉴定,对于HPLC因为常用的系统较少,加之其分离效果好,我们一般不要求选择三种分子间作用力不同的溶剂系统,只要求选这三种不同极性的溶剂系统,使目标峰在不同的保留时间出峰。
四,基于软电离质谱的纯度鉴定。如ESI-MS,APCI-MS。大极性化合物选用ESI-MS,极性很小的化合物选用APCI-MS,这些软电离质谱的特点是只给出化合物的准分子离子峰,通过正负离子的相互沟通来确定分子量。如果样品不纯,就会检出多对准分子离子峰,不但确定了纯度,还能明确混杂物的分子量。
五,基于核磁共振的纯度鉴定,从氢谱中如果发现有很多积分不到一的小峰,就有可能是样品是样品中的杂质。利用门控去偶的技术通过对碳谱的定量也能实现纯度鉴定。
化合物是由两种以上的元素以固定的摩尔比通过化学键结合在一起的化学物质。化合物可以由化学反应分解为更简单的化学物质。像甲烷(CH₄)、葡萄糖(C6H12O6)、硫酸铅(PbSO₄)及二氧化碳(CO2)都是化合物。
高中时极性可理解为电性。甲醇看成甲烷去掉一个氢,加上一个羟基,无论怎么放羟基分子都不对称,拉扯电子力不平衡,电性不平衡,所以是极性分子。且氧的电负性远强于碳,可知甲醇是强极性分子,
是共价化合物。主要以共价键结合形成的化合物,叫做共价化合物。不同种非金属元素的原子结合形成的化合物(如CO2、ClO2、B2H6、BF3、NCl3等)和大多数有机化合物,都属于共价化合物。在共价化合物...
有机锡作为防腐剂,催化剂,主要在烫金胶,粘合剂或者糊料中存在,使用环保化学品
与混合物区别
(1)化 合物组成元素不再保持单质状态时的性质;混合物没有固定的性质,各物质保持其原有性质(如没有固定的熔点和沸点)。
(2)化合物组成元素必须用化学方法才可分离;
(3)化合物组成通常恒定。混合物由不同种物质混合而成,没有一定的组成,不能用一种化学式表示。
(4)化合物是纯净物,并可以用一种化学式表示,而混合物则不是,也没有化学式。
与元素和单质区别
要明确单质和化合物是从元素角度引出的两个概念,即由同种元素组成的纯净物叫做单质,由不同种元素组成的纯净物叫做化合物。无论是在单质还是化合物中,只要是具有相同核电荷数的一类原子,都可以称为某元素。
三者的主要区别是:元素是组成物质的成分,而单质和化合物是指元素的两种存在形式,是具体的物质。元素可以组成单质和化合物,而单质不能组成化合物。
化合物与固溶体的区别
相同:均为单相材料。
不同:A和B形成固溶体后,其结构与主晶体一致,A与B间无确定的摩尔比,可以在一定范围内波动,如红宝石,A与B形成化合物AmBn后,生成物结构即不同于A也不同于B,是一种新结构,A与B存在一定摩尔比。

 元素化合物让物质绽放异彩——《铝的重要化合物》教学设计
元素化合物让物质绽放异彩——《铝的重要化合物》教学设计
元素化合物让物质绽放异彩——《铝的重要化合物》教学设计
元素化合物作为中学化学的基础知识,是学生了解多彩世界,体会化学魅力的主要途径;它为学生形成化学概念和理解化学理论提供了丰富的感性素材,也是化学概念和理论的用武之地;化学实验在此大放异彩,也成为学生最有兴趣学习的部分。

 铝及其化合物的性质
铝及其化合物的性质
铝及其化合物的性质
铝及其化合物的性质 一 .【实验目的】 1.了解金属铝的活泼性质,铝和其氧化物、氢氧化物的两性.铝热法还原反应原理。 2.掌握沉淀的生成离心、转移和铝热法的安全操作等实验技能。 二 .【实验原理 】 1.铝是亲氧元素,又是典型的两型元素,其单质,氧化物以及亲氧化物都能与强酸强碱 发生反应。 2.当铝接触空气或氧气,其表面会被生成的致密的氧化膜所覆盖,但是当氧化膜被破坏 或不能生成时,铝很快就会被氧化成三氧化二铝。 3.铝粉和金属氧化物粉末(如四氧化三铁)按一定比例混合,用引燃剂点燃,铝氧化时 放出大量的热,反应剧烈进行,得到氧化铝和还原的金属(如铁) ,称为铝热还原法。 三 .【实验用品 】 仪器和材料: 蒸发皿、试管、离心管、量筒、滴管、离心机、托盘天平、坩埚钳、三角架、 泥三角、镊子、细沙、砂纸、滤纸、玻棒、酒精灯、火柴、试管夹、脱脂棉 药品: 2mol/L HCL 、 3mol/LH
参见:Category:锑化合物。
锑化合物通常分为+3价和+5价两类。与同主族的砷一样,它的+5氧化态更为稳定。
氧化物与氢氧化物
三氧化二锑可由锑在空气中燃烧制得。在气相中,它以双聚体Sb4O6的形式存在,但冷凝时会 形成多聚体。五氧化二锑只能用浓硝酸氧化三价锑化合物制得。锑也VV能形成混合价态化合物--四氧化二锑,其中的锑为Sb(III)和Sb(V)。与磷和砷不同的是,这些氧化物都是两性的,它们不形成定义明确的含氧酸,而是与酸反应形成锑盐。
氢氧化物曾广泛用作溶剂、灭火剂、有机物的氯化剂、香料的浸出剂、纤维的脱脂剂、粮食的蒸煮剂、药物的萃取剂、有机溶剂、织物的干洗剂,但是由于毒性的关系现在甚少使用并被限制生产,很多用途也被铜锌合金等所替代。也可用来合成三氧化二锑、尼龙7、尼龙9的单体;还可制三氯甲烷和药物;金属切削中用作润滑剂。
锑能形成两类卤化物--SbX3和SbX5。其中三卤化物(SbF3、SbCl3、SbBr3和SbI3)的空间构型都是三角锥形。三氟化锑可以由三氧化二锑与氢氟酸反应制得:
这种氟化物是路易斯酸,能结合氟离子形成配离子SbF4和SbF5。熔化的三氟化锑是一种弱的导体。三氯化锑则由三硫化二锑溶于盐酸制得:
五卤化物(SbF5和SbCl5)气态时的空间构型为三角双锥形。但是转化为液态后,五氟化锑形成聚合物,而五氯化锑依旧是单体。五氟化锑是很强的路易斯酸,可用于配制著名的超强酸氟锑酸(HSbF6)。
锑的卤氧化物比砷和磷更为常见。三氧化二锑溶于浓酸再稀释可形成锑酰化合物,例如SbOCl和(SbO)2SO4。
这类化合物通常被视作Sb的衍生物。Sb金属性不强,能与金属形成锑化物,例如锑化铟(InSb),锑化银(Ag3Sb),锑钯矿(Pd5Sb2),方锑金矿(AuSb2),红锑镍矿(NiSb)等。碱金属和锌的锑化物,例如Na3Sb和Zn3Sb2比以上物质更为活泼。这些锑化物用酸处理可以生成不稳定的气体锑化氢(SbH3)。
锑化物一般以共价键链接,是电子云的重叠,所以共价键最本质的分类方式就是它们的重叠方式。σ键,π键,δ键在有机化合物中,通常把共价键以其共用的电子对数分为单键、双键以及三键。单键是一根σ键;双键和三键都含一根σ键,其余1根或2根是π键。但无机锑化物不用此法。原因是,无机锑化物中经常出现的共轭体系(离域π键)使得某两个原子之间共用的电子对数很难确定,因此无机物中常取平均键级,作为键能的粗略标准。
有机锑化合物一般可由格氏试剂对卤化锑的烷基化反应制备。已知有大量三价和五价的有机锑化合物--包括混合氯代衍生物,还有以锑为中心的阳离子和阴离子。例如Sb(C6H5)3(三苯基锑)、Sb2(C6H5)4(含有一根Sb-Sb键)以及环状的[Sb(C6H5)]n。五配位的有机锑化合物也很常见,例如Sb(C6H5)5和一些类似的卤代物。

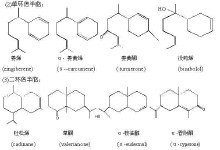
萜类化合物广泛存在于植物体内,是植物香精油(挥发油)的主要成分。萜类化合物种类很多,其结构类别也 不尽相同,但它们都可以看作是由两个或两个以上异戊二烯分子按不同方式首尾相连而成,此即称为萜类化合物结构的异戊二烯规律。其结构形式有开链式、环状式、饱和与不饱和烃类及其含氧衍生物,如醇、醛、酮等。根据它们的异戊二烯分子的单位数又可将其分为单萜(由两分子异戊二烯组成),以下按每增加一个异戊二烯单位,依次称之为倍半萜、二萜、三萜、四萜及多萜。在自然界中,单萜和倍半萜类是挥发油的主要成分;二萜以上多为植物的树脂、皂甙或色素的主要成分。单萜化合物又分为链状单萜(月桂烯、柠檬醛等)、单环单萜(柠檬烯、薄荷醇等)和双环单萜(松节油、龙脑、樟脑等)三类。倍半萜类主要包括合欢醇、山道年等;二萜类主要有植醇、维生素A和松香酸;甘草次酸属于五环三萜类;胡萝卜素则为四萜类。
甾体化合物属简单类脂,广泛存在于动植物的组织中,是一类重要的天然产物。胆固醇、胆汁醇、维生素D及各类甾体激素均属此类。其基本结构是环戊烷的母核及三个侧链,亦叫甾体母核。胆固醇是含有27个碳原子的胆甾醇,其化学名称为胆甾5-烯-3β-醇。它存在于人和动物体中,尤以动物脑、蛋黄及油脂中含量最高。胆固醇在化妆品中应用比较广泛,也是合成维生素D的重要原料。胆汁酸是含有24个碳原子的胆烷酸。在动物胆汁中,胆汁酸一般都是与甘氨酸或牛磺酸以肽键结合成胆盐,并以不同比例存在于动物胆汁中。

汞主要有两种氧化态,+1价和+2价。更高的氧化态不常见,在极不寻常的条件下也能产生,比如四氟化汞HgF4.
+1价汞的化合物
与同组的锌和镉不同的是,汞一般通过金属键形成简单稳定的化合物。大多数+1价汞的化合物是反磁性的,并且形成二聚离子Hg22+。稳定化合物包括盐酸盐和硝酸盐。+1价汞的络合物可以与强络合剂反应,例如硫离子和氰根离子等,发生歧化,生成Hg2+和单质汞。氯化亚汞,又名甘汞,无色固体,化学式为Hg2Cl2,原子的连接方式为Cl-Hg-Hg-Cl.它是电化学中的一种标准物质,有时还在医学中被应用。它可与氯气反应生成氯化汞。氢化亚汞,无色气体,化学式为HgH,其中没有汞-汞键。汞原子易于与自身结合,形成多原子分子。线性的汞原子链在中心,形成带正电的集团。例如Hg32+(AsF6-)2.
+2价汞的化合物
+2价是汞最常见的氧化态,也是自然界中非常重要的一种。汞的四种卤化物都存在。+2价汞离子与其他配合体形成正四面体的配合物,但是与卤素形成线性的配合物,与银离子类似。最常见的是氯化汞(又称氯化高汞,升汞,氯化汞(II)),一种易升华的白色固体,是腐蚀性极强的剧毒物品。氯化汞通常形成正四面体的配合物,例如HgCl42-。
氧化汞是汞的主要的氧化物,汞与高温空气长时间接触后产生。氧化汞加热至近400 °C会分解成汞和氧气。约瑟夫·普里斯特利早期制造纯氧时曾应用这一反应。与金和银的情况类似,人们对汞的氢氧化物了解较少。 汞很软,但是可以与较重的氧族元素形成稳定的衍生物。其中非常突出的是硫化汞,HgS。硫化汞在自然界中以辰砂矿的形式出现,是一种非常好的朱红色素,常用于印泥。朱砂也是一种矿石中药材,也是道士炼丹的一种=常用材料。与硫化锌一样,硫化汞也有两种晶体,红色的立方体和黑色的混杂硫化锌的晶体。硒化汞(HgSe)和碲化汞(HgTe)被已知存在,它们和其他一些衍生物,例如半导体碲化汞镉和碲化汞锌,都是很好的探测红外线的材料。
+2价汞的盐可与氨形成一系列的衍生物,包括米隆碱(Hg2N+),一维的高聚物 ((HgNH22+)n),易溶的白降汞([Hg(NH3)2]Cl2)。奈斯勒试剂,碘化汞钾,仍有时被用来测试氨的存在,因为氨容易于其反应形成深色的米隆碱的碘盐。
雷酸汞是一种广泛应用的烈性炸药,用于早期的雷管,但目前已被更稳定的起爆药所代替。
更高价的氧化态
高于+2价的氧化态而非离子形态的汞极为罕见。在羟汞化反应中可能会有一种中间产物是环状的有3个取代基的+4价汞离子。2007年,+4价汞的氟化物被合成出来。20世纪70年代曾有人声称合成出了+3价汞的化合物,但是现在普遍认为这是假的。
有机汞化合物
在历史上有机汞化合物很重要,但是在西方世界几乎没有工业价值。+2价的汞盐是极少的能直接与芳香环反应的简单的金属复合物。有机汞化合物总是2价的,配位数一般是2,形成直线型化合物。与有机镉和有机锌的化合物不同,有机汞不与水反应。有机汞一般形成HgR2或HgRX,前者多易挥发而后者多为固体。其中R是芳基或烷基,X一般是卤素或乙酸根。甲基汞表示一系列化学式为CH3HgX的化合物。甲基汞危害非常大,经常在被污染的河流或湖泊中。甲基汞会导致生物甲基化作用。
实验发现在电弧中惰性气体可以与汞蒸气发生相互作用(并未真正发生化学反应)。这些包合物(HgNe、HgAr、HgKr和HgXe)以范德华力相连。