选择特殊符号
选择搜索类型
请输入搜索
1.无特殊的燃烧爆炸特性。
2.在空气中稳定,加热至100~120℃则分解。
200℃时完全分解,失去二氧化碳和水而成碳酸钾。不溶于乙醇。0℃时,在100g水中的溶解度为22.4g;60℃时100g水可溶解60g碳酸氢钾。其水溶液呈弱碱性,长期放置会失去CO2,煮沸,则变为碳酸钾水溶液。在空气中,结晶是稳定的,加热到100℃时发生分解,转化为碳酸钾。
1.用作生产碳酸钾、醋酸钾、亚砷酸钾等的原料,亦用于医药、食品、灭火剂等行业。作酸度调节剂和化学膨松剂,我国规定可用于各类需添加膨松剂的食品,按生产需要适量使用。是生产碳酸钾、醋酸钾、亚砷酸钾的原料。可作石油和化学品之灭火剂。也可用于医药、焙粉。作酸度调节剂和化学膨松剂,我国规定可用于各类需添加膨松剂的食品,按生产需要适量使用。2.补充钾,用于治疗低钾症。3.用作碱性剂、膨松剂、营养增补剂、赋形剂及pH调节剂。GB2760—90,可用作加工助剂。可用于软饮料、焙烧食品等。4.用作分析试剂。发泡剂。
甲酸钾液体产品为无色透明液体,饱和溶液比重为1.58g/cm³,性质稳定。固体的甲酸钾为白色结晶粒状或片状,具有强吸湿性。甲酸钾能与酸类、氧化物发生反应。所以在储存和运输时要注意防潮和封装,...
1.化学性质:氰基乙酸乙酯含有活性亚甲基,与溴作用生成溴代氰基乙酸乙酯。与氨作用生成氰基乙酰胺。与乙醇作用生成丙二酸二乙酯。酸性比苯酚弱。在酸、碱存在下能发生水解。此外,氰基乙酸乙酯能...
1. 白色片状或叶状体结晶,易燃。易溶于水;醇;醚类有机溶剂,不溶于脂肪烃。常压蒸馏几乎不分解,长时间加热则失水而生成不饱和的γ-内酯。有吸湿性,水溶液酸性比乙酸强。2. 化学性质:能发生酮的反应和酸...
(1)碳化法原料碳酸钾可用三级品。也可以土碱为原料,其中含碳酸钾40%~60%、硫酸钾10%~15%、氯化钾3.5%,投料前需经煅烧除去有机物,借溶解度的不同除去硫酸钾及氯化钾,加石灰乳或碳酸镁经压滤可除去硅、铝、磷等杂质,滤液经蒸发,配制碳酸钾溶液,使总碱浓度为750~800 g/L(以碳酸钾计),进碳化塔。在温度50℃以上、反应压力0.4MPa下,通二氧化碳(浓度30%以上),进行碳化,碳酸氢钾随浓度升高而不断析出。碳化5~6h后母液经结晶分离、洗涤、离心分离、于80℃下干燥,制得碳酸氢钾成品。其反应方程式如下:(2)离子交换法 氯化钾溶液经除钙、镁逆流通入离子交换柱,使钠型树脂(R-Na)变成钾型(R-K),用软水洗去氯离子后,将碳酸氢铵溶液顺流通过树脂交换柱,得到碳酸氢钾和碳酸氢铵的混合稀溶液,经蒸发分解使大部分分解为碳酸钾,溶液送碳化塔进行碳化生成碳酸氢钾,再经结晶、分离、洗涤、干燥,制得碳酸氢钾成品。其反应方程式如下:
(3)由氢氧化钾的80%乙醇溶液或碳酸钾饱和溶液吸收二氧化碳制得产品。反应方程式如下:
4.由碳酸钾的饱和溶液或氢氧化钾的80%的乙醇溶液通入二氧化碳而得。
1.贮存在通风、干燥的仓库中。不宜在货棚或露天存放。应注意防潮。
2.运输装卸时,应防雨淋,保证干燥、包装不受损害和污染。不可与酸类共贮混运。
3.失火时,可用水、沙土和各种灭火器扑救。
1、性状:无色透明单斜晶系结晶或白色结晶。无臭、味咸。
2、密度(g/mL,25/4℃):2.17
3、相对蒸汽密度(g/mL,空气=1):不可用
4、熔点(ºC):292
5、沸点(ºC,常压):不可用
6、沸点(ºC,5.2kPa):不可用
7、折射率:1.482
8、闪点(ºC):不可用
9、比旋光度(º):不可用
10、自燃点或引燃温度(ºC):不可用
11、蒸气压(kPa,25ºC):不可用
12、饱和蒸气压(kPa,60ºC):不可用
13、燃烧热(KJ/mol):不可用
14、临界温度(ºC):不可用
15、临界压力(KPa):不可用
16、油水(辛醇/水)分配系数的对数值:不可用
17、爆炸上限(%,V/V):不可用
18、爆炸下限(%,V/V):不可用
19、溶解性:易溶于水(1g/0.8ml),其水溶液呈弱碱性,不溶于乙醇。溶于碳酸钾溶液。
中文名称:碳酸氢钾
英文名称:Potassium bicarbonate
中文别名:重碳酸钾
英文别名:bicarbonate; Potassium acid carbonate
CAS号:298-14-6
分子式:CHO3·K
分子量:100.114


 碳酸钠与碳酸氢钠性质的探究教学设计
碳酸钠与碳酸氢钠性质的探究教学设计
碳酸钠与碳酸氢钠性质的探究教学设计
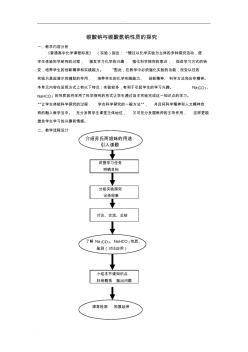
. . 碳酸钠与碳酸氢钠性质的探究 一、教学内容分析 《普通高中化学课程标准》 (实验)指出: “通过以化学实验为主体的多种探究活动,使 学生体验科学研究的过程, 激发学习化学的兴趣, 强化科学探究的意识, 促进学习方式的转 变,培养学生的创新精神和实践能力。 ”因此,在教学中必须强化实验的功能,改变以往的 实验只是起演示和辅助的作用, 培养学生的化学实践能力、 创新精神、 科学方法和合作精神。 本单元内容在呈现方式上有以下特点:实验较多,有利于引起学生的学习兴趣。 Na2CO3、 NaHCO 3 的性质我将采用了科学探究的形式让学生通过自主实验完成这一知识点的学习。 “让学生体验科学探究的过程, 学会科学探究的一般方法”, 并且将科学精神和人文精神自 然的融入教学当中。 充分发挥学生课堂主体地位, 又可充分发掘教师的主导作用, 这样更能 激发学生学习的兴趣和情感。 二、教学流程设计

 碳酸钠与碳酸氢钠性质地探究教学设计课题
碳酸钠与碳酸氢钠性质地探究教学设计课题
碳酸钠与碳酸氢钠性质地探究教学设计课题
实用文档 碳酸钠与碳酸氢钠性质的探究 一、教学内容分析 《普通高中化学课程标准》 (实验)指出:“通过以化学实验为主体的多种探究活动, 使 学生体验科学研究的过程, 激发学习化学的兴趣, 强化科学探究的意识, 促进学习方式的转 变,培养学生的创新精神和实践能力。 ”因此,在教学中必须强化实验的功能,改变以往的 实验只是起演示和辅助的作用, 培养学生的化学实践能力、 创新精神、 科学方法和合作精神。 本单元内容在呈现方式上有以下特点: 实验较多,有利于引起学生的学习兴趣。 Na2CO3、NaHCO3 的性质我将采用了科学探究的形式让学生通过自主实验完成这一知识点的学习。 “让学生体 验科学探究的过程,学会科学探究的一般方法” ,并且将科学精神和人文精神自然的融入教 学当中。 充分发挥学生课堂主体地位, 又可充分发掘教师的主导作用, 这样更能激发学生学 习的兴趣和情感。 二、教学流程设计 讲授
由甲醇和丁酸在硫酸催化下经酯化反应制得。
精制方法:常含有因水解产生的游离丁酸和甲醇。精制时用碳酸氢钾溶液洗涤,再用水洗涤,无水硫酸钠或碳酸钾干燥后蒸馏。
草碱又称钾碱,化学名称:碳酸钾,化学式:K2CO3。白色粉末状结晶,易溶于水,吸湿性很强,易结块,长期暴露在空碱气中会吸收二氧化碳,转变为碳酸氢钾。反应方程式:K2CO3+CO2+H2O(g)=2KHCO3。
K2CO3 又称钾碱,早期的品种之一。白色粉末状结晶,易溶于水,吸湿性很强,易结块,长期暴露在空气中会吸收二氧化碳,转变为碳酸氢钾,应密封包装。碳酸钾主要用于制造钾玻璃、钾肥皂和其他无机化学品,以及用于脱除工业气体中的硫化氢和二氧化碳,也用于电焊条、油墨制造、印染工业等方面。
将氯化钾配成250 g/L溶液,加入少量碳酸钾以除去钙、镁离子。碳酸氢铵也用水配成200 g/L溶液。将氯化钾溶液逆流通入离子交换柱,使钠型树脂R-Na变成钾型R-K,用软水洗掉树脂间隙中残留的氯离子,洗净后,将碳酸氢铵溶液顺流通过树脂交换柱,使树脂变为铵型R-NH4,得到碳酸氢钾和碳酸氢铵的混合稀溶液,经一次蒸发,使碳酸氢铵分解,再经二次蒸发使碳酸氢钾大部分分解为碳酸钾,冷却析出的氯化钾结晶过滤除去,然后三次蒸发至54°Bé过滤除去钾钠复盐。溶液经碳化,使碳酸钾成为碳酸氢钾,再经结晶、分离、水洗、煅烧,制得成品。其
R-Na+KCl→R-K+NaCl
R-K+NH4HCO3→R-NH4+KHCO3
2KHCO3→K2CO3+CO2↑+H2O
氯化钾溶解,浓度达270~300 g/L,加适量碳酸钾及氢氧化钾除去其中的钙、镁离子,溶液澄清后,用盐酸调至Ph8~10,在槽电压为2.8~3.5 V、槽温60~70℃下电解得浓度为10%~15%的氢氧化钾溶液,蒸发浓缩至氢氧化钾浓度为50%时,冷却至30~35℃,析出的氯化钾回收再用。浓碱液稀释至44%左右,进行预碳化,当氢氧化钾达30 g/L以下时,过滤除去氢氧化镁沉淀,再经浓缩除钠后,进行碳化,得粗碳酸钾,继续碳化得碳酸氢钾结晶,结晶经水洗、离心分离、煅烧,制得精制碳酸钾成品。其
2KCl+2H2O[电解]→2KOH+Cl2↑+H2↑
2KOH+CO2→K2CO3+H2O
K2CO3+CO2+H2O→2KHCO3
2KHCO3→K2CO3+CO2↑+H2O
主要利用各种植物壳,如桐子壳、棉子壳、茶子壳和葵花子壳等,烧制成草木灰,草木灰是碳酸钾、硫酸钾、氯化钾的混合物。用浸取、蒸发和结晶的方法,分别加以分离。净化方法有许多种,或加碳酸镁除磷,或通入二氧化碳预碳化除杂.或加石灰乳除磷、铝、硅等。需经二次蒸发、冷却、分离,再经干燥制得碳酸钾成品。因受原料来源的限制,此法不宜大规模生产,已被淘汰。
将硫酸钾、煤粉、石灰石按一定配比混合,加水搅拌。其中氯化钾控制在6%~8%,钠盐控制在8%~10%,然后在900~1000℃温度下进行焙烧得黑灰。
将黑灰粉碎,用热水浸取,浸液蒸发使部分未转化的硫酸钾析出,经分离后清液送碳化塔预碳化。碳化液加高锰酸钾使铝、硅、铁等杂质沉淀,滤液蒸发至碳酸钾、钠复盐及杂质沉淀析出,清液经二次碳化得粗制碳酸钾结晶,再经过滤、水洗,然后于500~600℃下在煅烧炉中进行煅烧成碳酸钾成品。其
K2SO4+2C+CaCO3→K2CO3+CaS+2CO2↑
K2CO3+CO2+H2O→2KHCO3
2KHCO3→K2CO3+CO2↑+H2O
碳酸钾用途:碳酸钾是重要的基本无机化工、医药、轻工原料之一,主要用于光学玻璃、电焊条、电子管、电视显像管、灯泡、印染、染料、油墨、照像药品、泡花碱、聚酯、炸药、电镀、制革、陶瓷、建材、水晶、钾肥皂及药物的生产。用作气体吸附剂,干粉灭火剂,橡胶防老剂。还用于脱除化肥合成气中二氧化碳。也可用作含钾肥料。随着高新技术的不断开发,碳酸钾在洗涤助剂和味精、食品等领域的应用也日趋扩大。无机工业用于制造酒石酸钾钠、铝氟酸钾、硫氰酸钾、钛白粉。医药工业用于制造长效磺胺、黄体酮、可的松、知阿可尔、苯甲酸雌二醇等药。玻搪工业用于珐琅粉配制,以增强其流平性,加入玻璃中起助熔作用,并提高玻璃透明度和折光系数。染料工业用于制造阴丹土林、分散红3B、还原灰M等。印染工业用于还原染料的印染和冰染的拔白。橡胶工业用于制造4010防老剂。毛麻棉工业用于棉布煮炼和羊毛的脱脂。
重质碳酸钾执行标准:HG/T2522-93
碳酸钾执行标准:GB/T 1587-2000
项目 | 指 标 | |
优等品 | 优等品 | 一格品 |
K2CO3 ≥ | 99.0%(WT) | 99.0%(WT) |
KCL ≤ | 0.01% | 0.03% |
K2SO4 ≤ | 0.01% | 0.04% |
Fe ≤ | 0.001% | 0.002% |
水不溶物 ≤ | 0.02% | 0.03% |
灼烧矢量 ≤ | 0.60% | 0.80% |
粒度(1.4mm筛余物) ≤ | 1.0% | 1.0% |
(180um筛余物)≥ | 90.0% | 85.0% |
堆积密度 ≥ | 1.4g/ml | 1.2g/ml |